在癌症治疗的前沿领域,ADC药物正逐渐崭露头角,成为对抗癌症的有力武器。ADC药物,即抗体-药物偶联物(Antibody-Drug Conjugate),它巧妙地将单克隆抗体的高特异性与小分子细胞毒性药物的强大杀伤力相结合,就像一枚精准制导的“生物导弹”,能够直击肿瘤细胞,最大限度地减少对正常细胞的损害。
ADC药物主要由三部分组成:抗体、连接子和细胞毒性药物。抗体就像是导弹的“导航系统”,它能够特异性地识别肿瘤细胞表面的特定抗原,如HER2、CD30等,这些抗原在肿瘤细胞上高度表达,而在正常细胞上则很少或不表达,从而保证了抗体能够准确地找到肿瘤细胞;连接子如同“桥梁”,负责将抗体和细胞毒性药物稳定地连接在一起,它需要在血液循环中保持稳定,避免药物提前释放,同时又要在肿瘤细胞内特定的环境下,如酸性条件或特定酶的作用下,能够及时裂解,释放出细胞毒性药物;细胞毒性药物则是真正发挥杀伤作用的“弹头”,它们通常是已经证实具有强大抗肿瘤效果的药物,如美登素、奥瑞他汀等,一旦释放,就能对肿瘤细胞的DNA、蛋白质合成或细胞分裂等关键过程进行破坏,从而诱导肿瘤细胞凋亡(如图1)[1]。
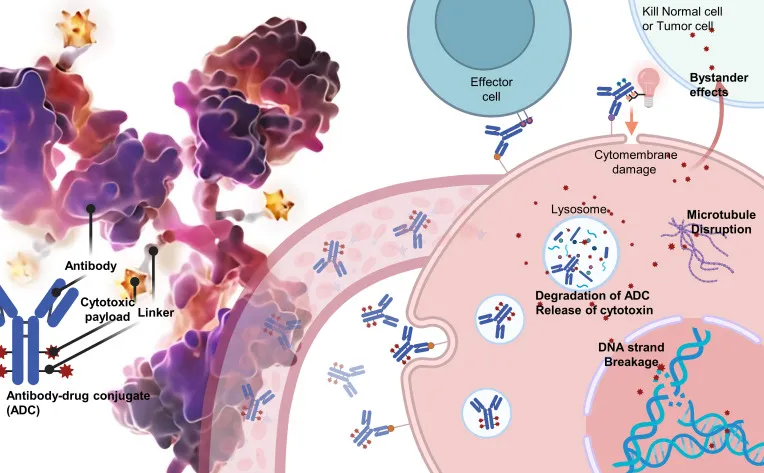
图1:ADC药物的结构和作用机制[2]
正是由于ADC药物这种独特的结构和作用机制,使其在癌症治疗中具有巨大的潜力,为众多癌症患者带来了新的希望。然而,要充分发挥ADC药物的优势,对其在体内的药代动力学过程进行精准监测至关重要,这就离不开高灵敏度的定量分析方法。
ADC药物定量检测的重要性
ADC作为一类特殊药物,结构极为复杂。它将大分子药物(抗体)与小分子药物(细胞毒性载荷)独特结合,这种分子结构特性,使得对其进行定量检测面临诸多复杂难题。由于ADC的结构复杂性,应从不同的角度进行ADC稳定性分析,包括linker、有效载荷和mAb组分的稳定性以及整个偶联组装体的稳定性。ADC药物在体内会存在多种形式的ADC分子和多个ADC药物的组成分子,包括未偶联抗体(裸抗)、偶联抗体、抗体偶联药物(这三者均对应总抗体),以及释放的小分子药物及其代谢产物[3]。
图2:ADC药物在体内会存在多种形式
在药物研发阶段,需要准确测定ADC药物的浓度、药物-抗体比(DAR)等参数,以评估药物的质量和稳定性,确保候选药物具有良好的成药性;在生产过程中,精确的定量检测是保障药品批间一致性的关键,只有严格把控每一批次ADC药物的质量,才能让患者用上安全有效的药物;而在临床应用中,通过检测患者体内ADC药物的浓度,临床可以优化给药方案,预测治疗效果,及时发现潜在的不良反应,为个体化治疗提供重要依据。
LBA检测平台:以高特异性与亲和力著称
原理与优势
配体结合分析(LBA)因其具有足够的灵敏度、良好的精密度以及高样本通量,是用于总抗体(TAb)和抗体-药物偶联物(ADC)测量的首选检测平台(如图2)。各种基于LBA的生物分析平台可用于ADC的生物分析,包括常规的ELISA、MSD和Gyros。每个平台都为LBA应用提供了独特的优势和限制。例如,MSD和Gyros平台与传统的ELISA平台相比,具有更高的灵敏度、更宽的动态范围、更低的样本量和更少的基质干扰[4]。LBA平台允许开发高通量、经济高效且易于实施的ADC生物分析方法,在ADC药物的早期研发和临床样本的初步分析中发挥着重要作用。
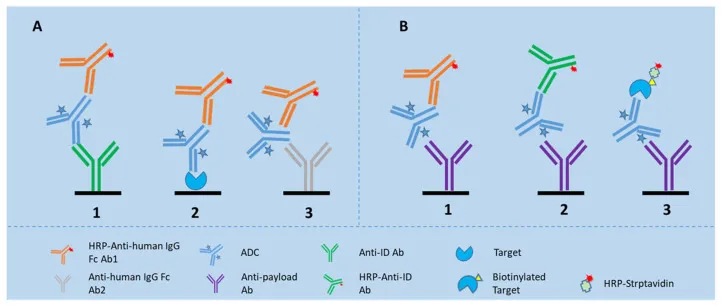
图3:LBA用于检测生物基质中总抗体(TAb)和抗体-药物偶联物(ADC)
在ADC药物定量检测中的应用
在ADC药物定量检测领域,LBA发挥着举足轻重的作用。在ADC药物研发的早期阶段,ELISA常用于评估药物的免疫原性。通过检测患者体内是否产生针对ADC药物的抗体,判断药物是否会引发免疫反应,影响治疗效果。此外,ELISA还可用于测定ADC药物在生物样本中的总浓度,帮助研究人员了解药物在体内的药代动力学特征,为确定合适的给药剂量和频率提供数据支持。
LC-MS/MS检测平台:以高灵敏度与精准度见长
原理与优势
液相色谱-串联质谱法(LC-MS/MS)结合了液相色谱的高效分离能力和串联质谱的高灵敏度、高特异性检测能力,通常被视为小分子分析最为适宜的平台。对于ADC药物而言,它通常用于小分子非共轭有效载荷的分析。由于细胞毒素具有高疏水性,循环中去偶联有效载荷的定量,通常是通过从生物基质中对分析物进行蛋白沉淀(PP)或固相萃取(SPE)或液-液萃取(LLE),随后采用多反应监测(MRM)模式进行LC-MS/MS分析来实现(如图4)。此外,LC-MS/MS平台还能够对小分子代谢物进行分析[5]。
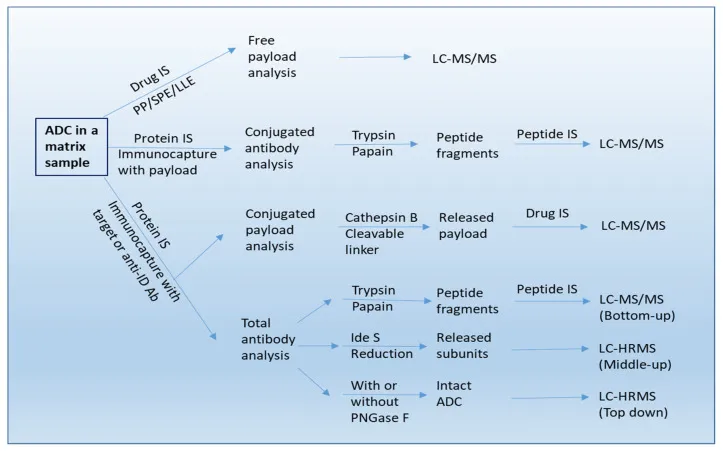
图4:LC-MS/MS平台多反应监测(MRM)模式
LC-MS/MS能够检测到极低浓度的ADC药物,灵敏度远超ELISA,对于痕量样本的分析具有显著优势。同时,它可以准确测定ADC药物的药物-抗体比(DAR)、鉴定药物的降解产物,为深入了解药物的作用机制和代谢过程提供丰富的数据。此外,LC-MS/MS具有较强的通用性,能够同时检测多种成分,适用于不同类型ADC药物的定量分析。
在ADC药物定量检测中的应用
在ADC药物的质量控制方面,LC-MS/MS是测定药物-抗体比(DAR)的金标准方法。通过精确测量抗体上连接的小分子药物数量,确保每一批次ADC药物的DAR值符合标准,保证药物的有效性和安全性。在临床研究中,LC-MS/MS可以准确检测患者血浆中ADC药物及其代谢产物的浓度,帮助医生了解药物在体内的动态变化,优化治疗方案。例如,在一项针对晚期乳腺癌患者的临床试验中,研究人员利用LC-MS/MS技术,实时监测患者体内ADC药物的浓度,根据检测结果调整给药剂量,显著提高了治疗效果,降低了不良反应的发生率。
联合应用
由于LBA和LC-MS/MS各有优缺点,在实际应用中,常将两种检测平台联合使用,实现优势互补。在ADC药物研发的初期阶段,可以利用LBA进行大规模样本的初步筛选,快速获取药物浓度的大致信息;在后续的深入研究和质量控制环节,则采用LC-MS/MS进行精确测定,获取药物结构和代谢方面的详细数据。在临床检测中,也可以先通过LBA对患者样本进行初筛,对于疑似异常的样本,再利用LC-MS/MS进行进一步确认和深入分析,这样既能提高检测效率,又能保证检测结果的准确性。
随着ADC药物研发的不断推进和临床应用的日益广泛,对其定量检测技术的要求也越来越高。LBA和LC-MS/MS作为两种重要的检测平台,在ADC药物的研究和应用中发挥着不可或缺的作用。未来,随着技术的不断创新和发展,相信这两种检测平台将不断优化升级,为ADC药物的研发、生产和临床应用提供更加精准、可靠的检测手段,助力生物医药领域取得更大的突破,为肿瘤患者带来更多的希望。
斯丹姆医药子公司安渡生物医药(杭州)有限公司(以下简称“安渡生物”)拥有先进完备的检测技术平台(如:酶标仪、MSD、液相色谱-质谱、流式细胞仪、qPCR等),可以提供各种研究性和合规性实验室检测分析:药代动力学,抗药抗体,中和抗体,细胞因子释放,免疫分型,药效学标志物检测。致力于不同治疗模式药物(单抗、双抗、抗体前药,抗体偶联药物、融合蛋白、多肽、细胞/基因治疗,核酸类药物,小分子化药等)的生物样本PK分析,免疫原性研究(抗药抗体检测、结构域特异性、中和抗体检测等)、生物标志物检测以及基于细胞平台的分析检测试验(细胞因子释放、中和抗体检测、受体占位、免疫细胞分型检测、ADCC、CDC)等,其位于杭州萧山的实验室每年可以支持上百个生物分析和生物标志物检测项目。
安渡生物分析实验室在ADC药物涉及的生物分析检测方面经验尤为丰富,在用LBA、 LC-MS/MS、流式细胞平台进行总抗体、偶联抗体、偶联药物、游离小分子的PK检测、ADC的免疫原性以及生物标志物测定等方面均有丰富的经验。已经成功建立使用Hybrid-immuno-capture-LC-MS/ MS平台对ADC总抗体、偶联抗体、偶联药物和游离小分子药物进行测定,对特异性抗体试剂的依赖程度低,可在短时间内建立方法,完成方法验证和样本分析,加速项目推进速度,助力药物研发。
参考文献:
[1] Fu Z,Li S,Han S,et al.Antibody drug conjugate: the“biological missile” fortargeted cancer therapy. Signal Transduct Target Ther. 2022;7:93.
[2] Li K, Xie G, Deng X,et al. Antibody-drug conjugates in urinary tumors: clinical application, challenge, and perspectives. Front Oncol. 2023 Dec 20;13:1259784.
[3] Cahuzac H, Devel L. Analytical Methods for the Detection and Quantification of ADCs in Biological Matrices. Pharmaceuticals (Basel). 2020 Dec 14;13(12):462.
[4] Myler H., Rangan V.S., Wang J., et al. An integrated multiplatform bioanalytical strategy for antibody-drug conjugates: A novel case study. Bioanalysis. 2015;7:1569–1582.
[5] Kaur S., Xu K., Saad O.M., Dere R.C., Carrasco-Triguero M. Bioanalytical assay strategies for the development of antibody-drug conjugate biotherapeutics. Bioanalysis. 2013;5:201–226.
更新后的指南草案涉重点关注临床试验设计、监管考虑,以及这些试验是否能够证明药物能够维持根据BMI确定的减肥效果。
在前面三期的临床数据管理“PM”养成系分享内容中我们介绍了三个主题内容:明确临床试验各方职责范围划分的项目范围管理;运用公司及个人资源以完成数据管理工作的项目资源管理;如何通过制定时间线计划和进度跟进以完成项目重要里程碑事件的项目进度管理。这期我们分享的是兼顾项目管理与项目可交付成果两个方面的项目质量管理。
我们一起来回顾下前两次分享的临床数据管理“PM”养成系列的内容:首先是明确临床试验各方职责范围划分的项目范围管理,然后是运用公司及个人资源以完成数据管理工作的项目资源管理。这一期我们会针对项目管理的重头戏—项目进度管理来展开数据管理活动时间线计划和进度跟进的内容分享,在保证数据质量的前提下高效完成数据管理相关工作以达成项目重要里程碑事件。
在上一期的分享中,我们一起学习了数据管理工作相关的项目范围管理,分别识别了数据清理和数据管理活动的各方职责范围划分。在确定数据管理工作范围后,这一期我们一起学习如何调动工作范围内的相关资源,来更高效、更高质量地展开数据管理相关工作。
上海斯丹姆疫苗数据管理部联合国际项目部共同开展《项目管理知识在数据管理工作中的应用》主题系列培训。《项目管理知识在数据管理工作中的应用》包含项目整合管理、项目范围管理、项目进度管理、项目质量管理、项目资源管理、项目沟通管理、项目风险管理、项目相关方管理等八个模块内容,主要参考项目管理知识体系指南(PMBOK指南)的理论知识,并结合数据管理工作内容和项目实践经验进行展开。
2025年6月19日国家药品监督管理局药品审评中心(CDE)发布《关于公开征求《创新药临床试验申请申报资料要求》等相关文件(征求意见稿)意见的通知》
FDA将于2025年7月23日做出最终审评决定,但ODAC的负面投票预示批准可能性较低。此次ODAC的决定凸显了FDA对安全性、剂量优化和本土数据的严格要求,可能影响未来药物的审评趋势。
近期,斯丹姆医药正在协助某中国生物科技公司在澳大利亚完成一项治疗实体瘤的国际多中心Ⅰ期临床试验。项目期间,斯丹姆团队展现了卓越的海外项目执行能力,团队凭借对澳大利亚药品管理局(TGA)法规的深入理解,高效完成了药监相关资料递交。
2025年6月26日,FDA宣布针对七款获批BCMA和CD19自体CAR-T细胞疗法取消风险评估(REMS)要求,确定不再需要REMS来确保这些CAR-T疗法的获益大于风险。这一重要的监管策略调整反映了该领域不断增长的临床专业知识和安全数据,是FDA细胞治疗监管的重要里程碑。
本期与大家分享数据管理中的医学编码-MedDRA编码其英文全称为 Medical Dictionary for Regulatory Activities,官方中文名字是《监管活动医学词典》,是药物安全性监测领域中不可或缺的工具。
斯丹姆已经成功建立使用Hybrid-immuno-capture-LC-MS/ MS平台对ADC总抗体、偶联抗体、偶联药物和游离小分子药物进行测定,对特异性抗体试剂的依赖程度低,可在短时间内建立方法,完成方法验证和样本分析,加速项目推进速度,助力药物研发。