创新药的开发已经成为药品开发中最为重要的组成部分,为了更好的指导创新药品的开发中美欧药监机构设置了多种药品开发过程中的沟通路径,以方便申办方与药监机构更好的互动并及时对开发过程中遇到的关键问题获得指导。
药品开发不同阶段适宜的沟通申请类型如下图所示:
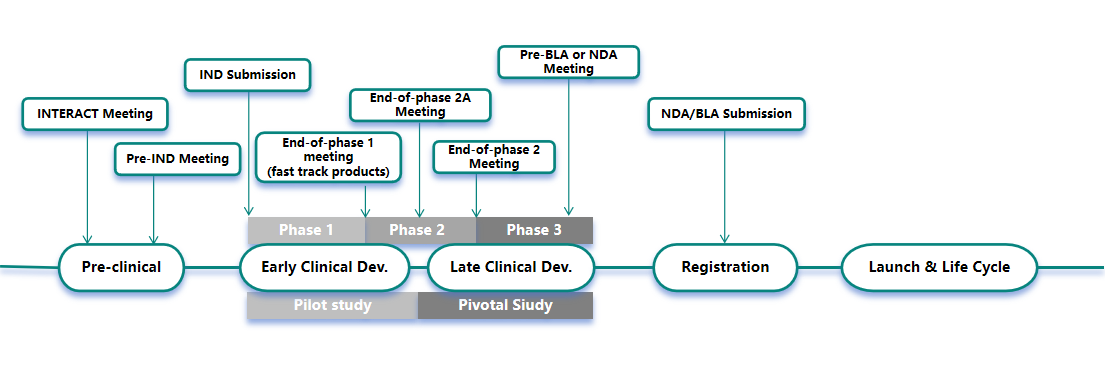
中美欧药品开发注册沟通交流介绍如下:
中国
中国国家药品监督管理局药品审评中心(CDE)针对药品开发的不同阶段设置了不同类型的沟通交流会,目的在便于药物研发与注册申请技术审评过程中,申请人与药审中心审评团队就现行药物研发与评价指南不能涵盖的关键技术等问题所进行的沟通交流。
1、沟通交流的形式:面对面会议、视频会议、电话会议或书面回复。
2、沟通交流会议分类:
Ⅰ类会议:
系指为解决药物临床试验过程中遇到的重大安全性问题和突破性治疗药物研发过程中的重大技术问题,而召开的会议。
召开时限:Ⅰ类会议一般安排在申请后30个工作日内。
Ⅱ类会议:
系指为药物在研发关键阶段而召开的会议。
包括的会议类型:
新药临床试验申请前会议(Pre-IND);
药物Ⅰ期临床试验结束/药物Ⅱ期临床试验结束(或启动前)/Ⅲ期临床试验启动前会议(EOP1/EOP2);
新药上市许可申请前会议(Pre-IND/BLA);
风险评估和控制会议;
申请附条件批准和/或适用优先审评审批程序的沟通会议。
召开时限:Ⅱ类会议一般安排在申请后60个工作日内。
Ⅲ类会议:
系指除Ⅰ类和Ⅱ类会议之外的其他会议。
包括的会议类型:
新增适应症及新增药物联用的临床申请;
讨论临床急需或罕见病药物药法过程中的重要问题;
讨论复杂仿制药、一致性评价或再评价品种的重大研发问题;
讨论复杂的重要非临床研究的设计方案;
讨论与药审中心的技术分岐;
前沿技术领域药物的讨论;
上市后的变更相关问题的讨论;
临床试验期间,对于安全性评估及风险管理存在问题的讨论;
讨论上市后临床试验设计。
召开时限:Ⅲ类会议一般安排在申请后75个工作日内。
中国药审中心设置的以上会议均不会产生任何官方费用。
欧盟
欧盟的沟通交流会议包含科学咨询(Scientific Advice,SA)或者临床研究方案协助会议(Protocol Assistance,PA)和上市许可申请前会议(Pre-MAA)。
人用药品委员会(Committee for Medicinal Products for Human Use,CHMP)根据科学咨询工作组(Scientific Advice Working Party, SAWP)对于不同产品在不同开发阶段的不同建议,为申请人提供SA与PA的沟通交流方式。无论在药品研发初期还是批准上市后的任何阶段,申请人都可以向EMA申请SA或者PA。
申请人在药品开发过程中,通常的申请阶段为,在I期临床试验后(EOP1)或者获得II期临床试验数据后(EOP2)申请进行沟通交流。通过沟通交流可以帮助申办方或者开发企业评估其相关研究是否充分,若EMA没有对研究提出较大的反对意见以及担忧,则可能会加速该药物的上市许可;若EMA提出较大反对意见,则可能会影响产品的上市审批进度。
SA会议简介:
SA会议的目的:为申办方创新药品开发的具体问题提供科学合理的建议。
SA会议涉及的问题:药学方面、药理毒理方面、临床方面、统计学方面、整体开发策略、孤儿药认定以及儿科适应症开发计划等。
SA会议时限:科学建议工作组(SAWP)每月定期召开会议讨论申请人的问题,EMA每年会定期公布每年度科学建议小组会议召开时间,申请人要按照所公布时间及时提交会议申请。
SA会议费用:EMA对科学咨询会收取费用,费用根据咨询的范围而有所不同,目前费用为:51800欧元-103800欧元不等。
美国
美国FDA与中国CDE沟通交流会议的设置基本类似,但同时也存在有些会议分类和解释方面的差异。美国食品和药物管理局 (FDA) 在创新药物开发过程中会通过一系列常规的正式会议为申办方提供指导和答疑的机会,沟通交流会议类型包括A类、B类、B类(EOP)和 C 类会议等。
1、沟通交流的形式:面对面会议、视频会议、电话会议或书面回复。
2、沟通交流会议分类:
A 类会议:
针对创新药开发过程中已暂停的开发项目的恢复,或解决目前药品开发阶段遇到的重要安全问题。
包括的会议类型:
21CFR10.75、312.48 和 314.103 中提及的问题和异议解决会议;
讨论药物开发中因为各种原因引起的临床暂停情况,并着眼于讨论可解决已有问题新的开发方向会议;
一般收到 FDA 根据特殊临床方案评估程序的评估后,申办方要求召开的特殊临床方案评估会议;
在 FDA 做出监管行动(批准除外)的 3 个月内要求召开的 Post-action 会议;
在 FDA 发出拒绝申请信函(refuse-to-file letter)后 30 天内要求召开的会议。
会议时限:FDA会议安排时间为收到申请后30个日历日内。
B 类会议:
与产品开发计划或过程中的主要里程碑相关。
包括的会议类型:
Pre-IND会议;
Pre-EUA会议;
审查综合疗效总结 (ISE) 和综合安全性总结 (ISS)的会议;
在 FDA 做出监管行动(批准除外)3 个月以后要求召开的 Post-action 会议;
在上市申请审查范围之外的,针对产品风险评估和应对策略或上市后要求的会议;
讨论获得突破性疗法认证的产品的整体开发计划会议。
会议时限:Pre-IND FDA响应时间21个日历日,FDA会议安排时间为收到申请后60个日历日内;Pre-NDA/BLA响应时间14个日历日,FDA会议安排时间为收到申请后70个日历日内。
B 类(EOP)会议:
在药物开发过程中,完成某一特定阶段后、并准备进入下一个阶段前举行的会议。
包括的会议类型:
一期临床试验结束后(EOP1)针对治疗危及生命和严重衰竭性疾病的生物制品和获得加速批准并用于严重/危及生命的的药物;
EOP2/3。
会议时限:响应时间14个日历日,FDA会议安排时间为收到申请后70个日历日内。
C 类会议:
不属于 A 类、B 类或 B (EOP) 类会议的沟通交流会议,对于有关产品开发和审查的主题会议。
包括的会议类型:
EOP2A会议;
OTC 各论反馈会议;
Phase 4会议。
会议时限:FDA响应时间21个日历日,FDA会议安排时间为收到申请后75个日历日内。
Interact会议:
复杂治疗手段、创新治疗手段、先进治疗手段以及创新类生物制品的申办方与 CBER 之间举行的非正式会议,旨在从 FDA 获得关于 CMC、药理学/毒理学和/或临床开发计划方面的非约束性建议。CBER 基于这些早期互动能够了解该创新性类产品的开发可能会带来与未知的安全性、复杂的制造工艺、技术和问题、创新性设备以及尖端检测方法的使用相关的独特挑战。
会议时限:FDA响应时间21个日历日,FDA会议安排时间为收到申请后90个日历日内。
与CDE一样,FDA设置的以上会议均不会产生任何官方费用。
总体上,创新药开发过程中中国 CDE 和美国 FDA 对于药品开发注册沟通交流会议设置类型的相似度较高,除了 FDA 特别设置的Interact会议以及会议时限上的差别之外,整体的会议设置以及缴费缴纳等方面基本一致。
欧盟药品注册沟通交流会议设置类别相对简单,但包含的内容较为丰富,基本包含了中美沟通交流会议所涉及内容,并且需要根据沟通内容的多少进行不同费用的缴纳。
作为深耕临床CRO领域20年的国际化企业,斯丹姆医药拥有国内专业的注册团队,精通全球药品法规,与国际前沿接轨,已成功助力国内外客户完成多项治疗药物、疫苗及医疗器械的全球申报注册,为医药创新成果走向世界铺平道路。期待与更多伙伴携手,共赴医药合作的星辰大海。欢迎随时联系。
更新后的指南草案涉重点关注临床试验设计、监管考虑,以及这些试验是否能够证明药物能够维持根据BMI确定的减肥效果。
在前面三期的临床数据管理“PM”养成系分享内容中我们介绍了三个主题内容:明确临床试验各方职责范围划分的项目范围管理;运用公司及个人资源以完成数据管理工作的项目资源管理;如何通过制定时间线计划和进度跟进以完成项目重要里程碑事件的项目进度管理。这期我们分享的是兼顾项目管理与项目可交付成果两个方面的项目质量管理。
我们一起来回顾下前两次分享的临床数据管理“PM”养成系列的内容:首先是明确临床试验各方职责范围划分的项目范围管理,然后是运用公司及个人资源以完成数据管理工作的项目资源管理。这一期我们会针对项目管理的重头戏—项目进度管理来展开数据管理活动时间线计划和进度跟进的内容分享,在保证数据质量的前提下高效完成数据管理相关工作以达成项目重要里程碑事件。
在上一期的分享中,我们一起学习了数据管理工作相关的项目范围管理,分别识别了数据清理和数据管理活动的各方职责范围划分。在确定数据管理工作范围后,这一期我们一起学习如何调动工作范围内的相关资源,来更高效、更高质量地展开数据管理相关工作。
上海斯丹姆疫苗数据管理部联合国际项目部共同开展《项目管理知识在数据管理工作中的应用》主题系列培训。《项目管理知识在数据管理工作中的应用》包含项目整合管理、项目范围管理、项目进度管理、项目质量管理、项目资源管理、项目沟通管理、项目风险管理、项目相关方管理等八个模块内容,主要参考项目管理知识体系指南(PMBOK指南)的理论知识,并结合数据管理工作内容和项目实践经验进行展开。