法规背景
《药物警戒质量管理规范》第五十五条持有人应当对各种途径收集的疑似药品不良反应信息开展信号检测,及时发现新的药品安全风险。
行业现状
药品的安全风险信号检测是药物警戒管理工作中十分关键的环节,法规以及各相关指南反复强调其重要性。如今作为热门话题,诸多同行纷纷聚焦多种信号检测方法的探索与实践。让大部分药物警戒从业者困惑的是:信号检测工作如何起步,哪些途径可以检测出信号,是否一定要依赖计算机辅助检测呢,是否每个产品的信号检测方式都是一样的呢.....
目前多数国内企业的药物警戒系统或未配置计算机信号检测模块,或虽配置了通用模块,却因缺乏对企业自身特性和需求的深度考量,无法实现精准匹配,导致难以发挥其应有的效能。因此,当前的大环境之下,人工检测仍然是经济可靠而且行之有效的方式。
因法规监管要求不同、企业管理运营模式不同,数据来源与特征不同等因素影响,信号检测人员第一步应该去思考的是:如何为产品“量身定制”一套最优的信号检测策略!
探索与实践
斯丹姆药物警戒质量体系依据ISO 90001质量管理体系要求、临床试验质量管理规范、药物警戒质量管理规范等,以国际化、多元化的视角,建设一个完善药物警戒质量管理体系,聚焦于药物警戒的核心安全管理要求。斯丹姆药物警戒团队配置临床医学、药学、统计学等多学科高级人才,面对当前的行业现状,我们积极探索,以GVP规范为基石,打破传统 “一刀切” 的固化思维模式,综合考虑产品的特性、上市年限、注册国家、产品适应症、特殊人群使用情况、企业信息化水平及药物警戒资源等因素,进行全面且细致的考量,为企业所持有的药品量身定制信号检测策略,致力于构建及时、全面且精准识别产品风险的高效机制。
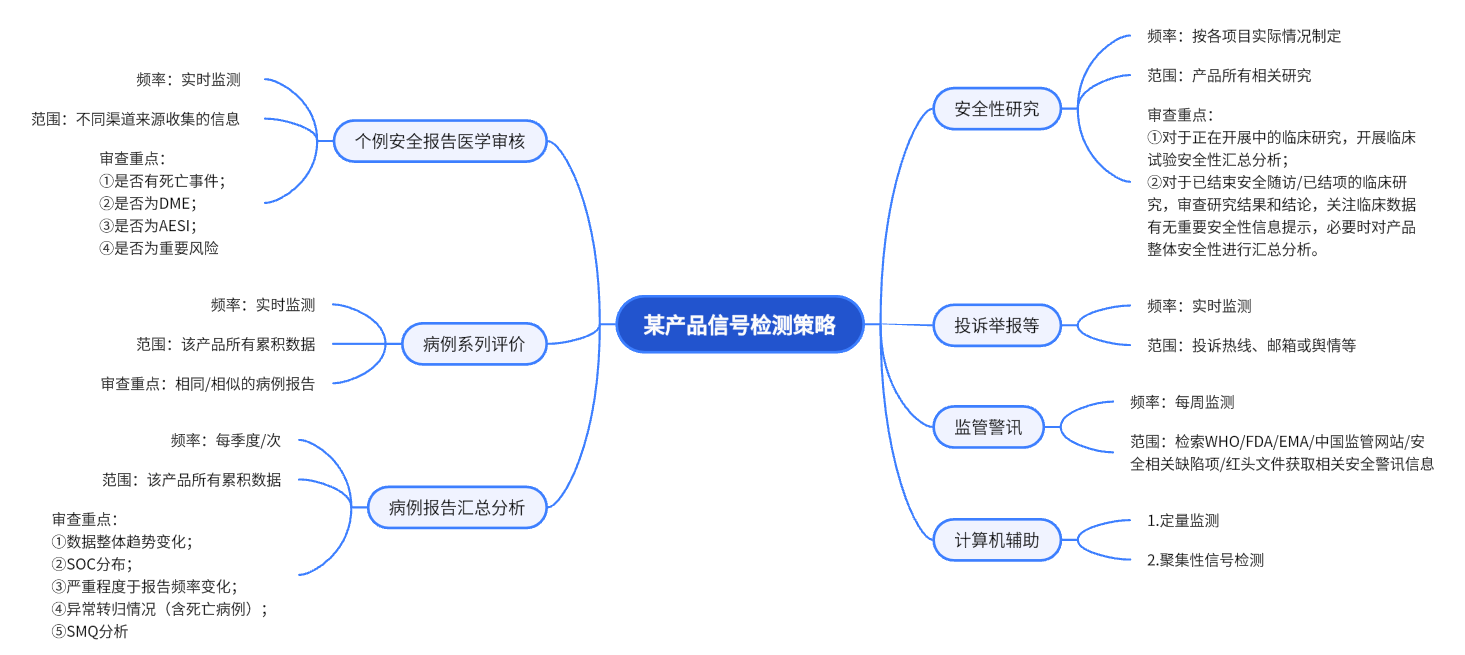
药物警戒人员应围绕个例报告审阅、监管部门关注或质疑、投诉举报开展实时信号检测;同时定期开展监管发布的药物安全信息、非临床/临床安全性研究、病例报告汇总分析等,完善产品整体安全信息的信号检测工作。通过一系列的探索与实践,我们可为企业的每个不同产品制定一套个性化、科学、系统的信号检测策略,并辅导企业开展实际工作。
信号策略思维导图展示:
更新后的指南草案涉重点关注临床试验设计、监管考虑,以及这些试验是否能够证明药物能够维持根据BMI确定的减肥效果。
在前面三期的临床数据管理“PM”养成系分享内容中我们介绍了三个主题内容:明确临床试验各方职责范围划分的项目范围管理;运用公司及个人资源以完成数据管理工作的项目资源管理;如何通过制定时间线计划和进度跟进以完成项目重要里程碑事件的项目进度管理。这期我们分享的是兼顾项目管理与项目可交付成果两个方面的项目质量管理。
我们一起来回顾下前两次分享的临床数据管理“PM”养成系列的内容:首先是明确临床试验各方职责范围划分的项目范围管理,然后是运用公司及个人资源以完成数据管理工作的项目资源管理。这一期我们会针对项目管理的重头戏—项目进度管理来展开数据管理活动时间线计划和进度跟进的内容分享,在保证数据质量的前提下高效完成数据管理相关工作以达成项目重要里程碑事件。
在上一期的分享中,我们一起学习了数据管理工作相关的项目范围管理,分别识别了数据清理和数据管理活动的各方职责范围划分。在确定数据管理工作范围后,这一期我们一起学习如何调动工作范围内的相关资源,来更高效、更高质量地展开数据管理相关工作。
上海斯丹姆疫苗数据管理部联合国际项目部共同开展《项目管理知识在数据管理工作中的应用》主题系列培训。《项目管理知识在数据管理工作中的应用》包含项目整合管理、项目范围管理、项目进度管理、项目质量管理、项目资源管理、项目沟通管理、项目风险管理、项目相关方管理等八个模块内容,主要参考项目管理知识体系指南(PMBOK指南)的理论知识,并结合数据管理工作内容和项目实践经验进行展开。
2025年6月19日国家药品监督管理局药品审评中心(CDE)发布《关于公开征求《创新药临床试验申请申报资料要求》等相关文件(征求意见稿)意见的通知》
FDA将于2025年7月23日做出最终审评决定,但ODAC的负面投票预示批准可能性较低。此次ODAC的决定凸显了FDA对安全性、剂量优化和本土数据的严格要求,可能影响未来药物的审评趋势。
近期,斯丹姆医药正在协助某中国生物科技公司在澳大利亚完成一项治疗实体瘤的国际多中心Ⅰ期临床试验。项目期间,斯丹姆团队展现了卓越的海外项目执行能力,团队凭借对澳大利亚药品管理局(TGA)法规的深入理解,高效完成了药监相关资料递交。
2025年6月26日,FDA宣布针对七款获批BCMA和CD19自体CAR-T细胞疗法取消风险评估(REMS)要求,确定不再需要REMS来确保这些CAR-T疗法的获益大于风险。这一重要的监管策略调整反映了该领域不断增长的临床专业知识和安全数据,是FDA细胞治疗监管的重要里程碑。
本期与大家分享数据管理中的医学编码-MedDRA编码其英文全称为 Medical Dictionary for Regulatory Activities,官方中文名字是《监管活动医学词典》,是药物安全性监测领域中不可或缺的工具。
斯丹姆已经成功建立使用Hybrid-immuno-capture-LC-MS/ MS平台对ADC总抗体、偶联抗体、偶联药物和游离小分子药物进行测定,对特异性抗体试剂的依赖程度低,可在短时间内建立方法,完成方法验证和样本分析,加速项目推进速度,助力药物研发。
从变更类型分布来看,变更共计556条(涉及30项SOC(System Organ Class,系统器官分类)),其中删除了一些不再适用的术语47项(涉及15项SOC)。变更最多的是“澄清”类变更,对原有术语的分级标准进行了大量澄清和细化(特别是2、3级标准)。其次是“新增:导航说明”和“新增: 术语”类变更,为临床试验提供更明确的操作指引,提高了临床试验数据收集的规范性,新增的多项专业术语,也使临床评估更便捷和统一。
诺和诺德的司美格鲁肽(Wegovy® 2.4 mg)近期捷报频传:继获得代谢功能障碍相关脂肪性肝炎(MASH)适应症批准后,其口服制剂在肥胖治疗竞赛中也占据领先地位。
文章深入探讨了文档管理不善可能引发的三大风险场景(稽查危机、效率黑洞、责任困难),并构建了以“规范性、可追溯性、及时性、准确性”为核心的稳固文档管理体系。同时,我们聚焦于“项目启动阶段”,阐述了如何在数据库上线前及时准确无误的完成启动前文档的定稿,为整个临床试验奠定坚实的基石。
本文系统梳理目前已获批的GLP-1相关减重药物的有效性、安全性及应用进展,以期为临床实践提供参考。
FDA认为,对比性临床研究在检测产品差异方面不如现代分析技术灵敏,证明生物类似药与参照药的高度相似性可以不再必须进行对比性临床研究。 全面的质量对比分析、结合临床药代动力学研究和人体免疫原性评估,即可作为证明生物相似性的充分科学依据。
本文由斯丹姆生物分析团队撰写,聚焦肺炎链球菌疫苗研发,详解其免疫原性评价的核心技术。斯丹姆子公司安渡生物(杭州)已建立完整技术平台和经验丰富的团队,可在短时间内完成样本分析,加速项目推进速度。
本文由斯丹姆生物分析团队撰写,深入解析mRNA技术的原理、递送系统与优势,全面盘点其在传染病预防、肿瘤治疗、蛋白替代三大领域的应用与临床突破,并阐述关键生物分析方法。
本文为斯丹姆生物分析团队撰写,探讨In vivo CAR-T疗法,该疗法具有制备简化、周期短、可及性高等优势,也面临体内动态分布等挑战;需建立药代、药效、免疫原性、安全性四方面生物分析策略,与主流 ex vivo CAR-T互补共存。