项目相关方管理包括用于开展下列工作的各个过程:识别能够影响项目或会受项目影响的人员、团体或组织,分析相关方对项目的期望和影响,制定合适的管理策略来有效调动相关方参与项目决策和执行。项目相关方管理包括以下四个过程:识别相关方、规划相关方参与、管理相关方参与、监督相关方参与[1]。每个项目都有相关方,他们会受项目的积极或消极影响,或者能对项目施加积极或消极的影响。有些相关方影响项目工作或成果的能力有限,而有些相关方可能对项目及其期望成果有重大影响。所以在遇到问题时,我们首先需要识别问题所涉及的相关方,并对不同的相关方在此问题中的期望、态度等信息进行分析,然后采用不同的策略来进行问题的沟通和解决。
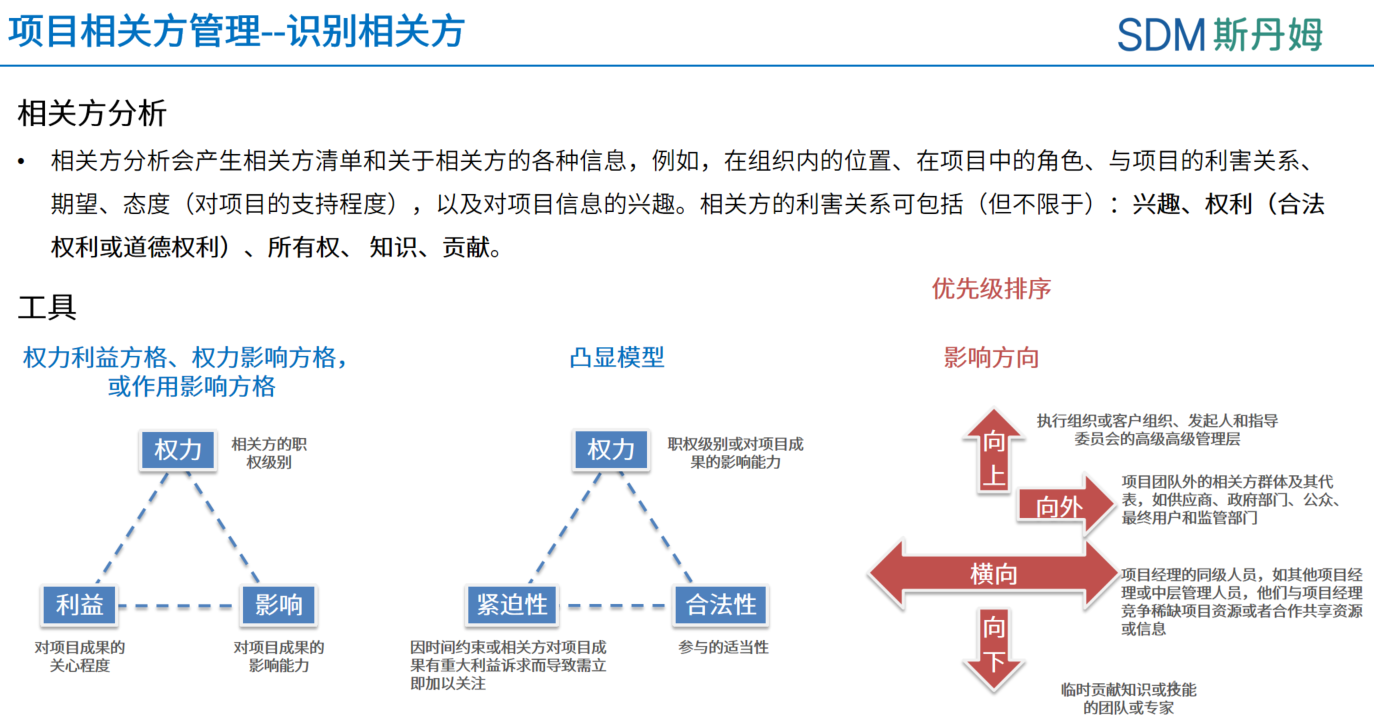
识别数据管理工作中的相关方
在数据管理相关的各项工作中,主要数据管理员(PCDM,Primary Clinical Data Manager)需要与多方的人员进行沟通与合作。需PCDM横向进行信息资源共享的相关方通常指不同职能部门的项目成员,如项目经理、医学监查、药物警戒经理、生物统计师、程序员等。向下(向内)需要与数据管理内部团队的成员如数据管理员(盲态和非盲)、数据库建库员、医学编码员等沟通合作,必要时也可向部门内部的专家(SME, Subject Matter Expert)寻求帮助。需向外进行沟通的人员通常有外部数据的第三方检测方、EDC/随机系统/ePRO供应商、申办者等。除此之外,PCDM如果遇到一些棘手或者风险较高的问题,需要向上反馈寻求资源支持、技术指导以及加大进程推动和问题解决的力度,也会涉及到PCDM的直线经理或相关方的直线经理。
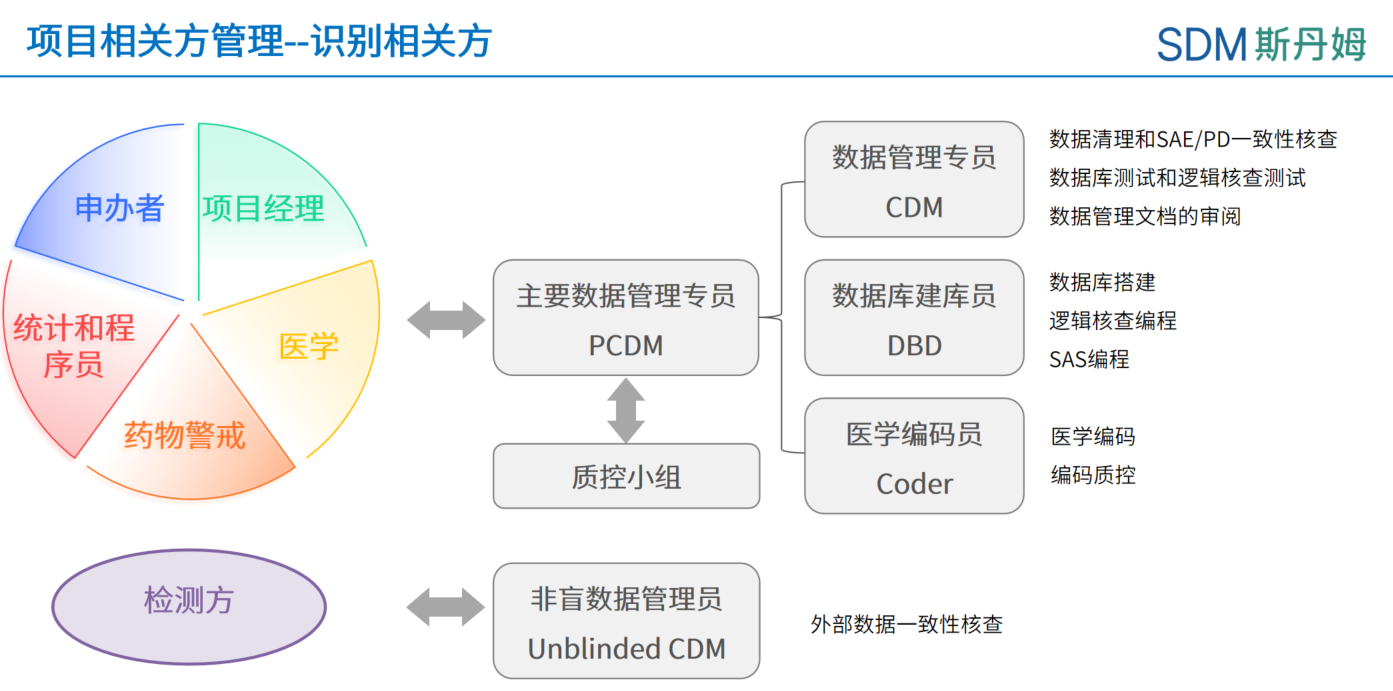
俗话说:知彼知己,百战不殆。在数据管理工作中,为了更好的与相关方进行合作与沟通,我们先来分别了解一下数据管理相关方的工作概况。
项目经理(PM,Project Manager)是项目从准备阶段到项目关闭阶段承上启下的重要人员。PM除了需要完成个人负责的项目管理(如计划时间线等)相关工作,还需协调各个业务团队的工作,以确保整个项目的工作可以按照项目时间线进行推进。在项目启动阶段,PCDM需要与PM确认项目首例入组时间、EDC/随机系统等系统供应商的选择及付款方式、申办者医学编码词典的版权等。如项目涉及多个沟通方,也需要与PM确认有关数据管理工作的沟通线,如数据管理工作相关沟通(如数据文档审阅、数据库测试、数据清理进展等)是由PCDM直接与申办者数据管理成员沟通,还是由两方的PM进行对接;与研究者的沟通是由研究中心负责的LCRA对接,还是由PM对接。在项目实施阶段,PCDM可向PM了解研究中心的入组和数据录入计划,以便适时地安排数据清理工作。同时,PCDM也需要向项目组定期反馈数据进展,如SDV率、数据录入率、质疑回复率等,提示PM需要关注的数据风险。若因数据核查计划纳入新的核查涉及批量数据问题,PCDM应在发送质疑前提前和PM进行沟通,PM可协调CRA对研究中心进行相关数据录入培训,以避免DM集中发送大批质疑使研究者措手不及。若项目开展过程中遇方案更新,PM需及时告知项目组方案更新版本及生效日期,视情况协调医学团队进行方案更新培训。PCDM在获知方案更新进展后需判断是否进行数据管理文件及数据库的更新,如需要PCDM则需计划数据库更新时间线和内容。另外,并不是所有项目会议都由PM统一组织协调,如遇数据相关问题,PCDM也可以组织项目会议,协调多方进行讨论。

数据管理工作相关方工作概况之项目经理
通常PCDM直接合作的医学团队成员包括医学写作(MW,Medical Writer)和医学监查(MM,Medical Monitor)。医学写作主要负责临床试验综述、方案、知情同意书(ICF,Informed Consent Form)、研究者手册(IB,Investigator's Brochure)、日记卡、临床研究报告(CSR,Clinical Study Report)等文件的撰写。医学监查会针对安全性、入排标准等数据进行医学角度核查,并对安全性、研究药物及试验的其他相关步骤提供建议。在项目进行的各个阶段,PCDM与医学团队成员也需要密切配合。在启动阶段,医学监查需审阅多个数据管理文档,包括但不限于病例报告表(CRF,Case Report form)、数据管理计划(DMP,Data Management Plan)、数据核查计划(DVP,Data Validation Plan)、电子病例报告表填写指南(eCCI,electronic Case Report Form Completion Instruction)等。在项目实施阶段,医学监查需参与医学编码审核、方案偏离(PD,Protocol Deviation)审核,并对EDC中的数据进行医学审核。如遇到和医学判断相关的数据问题,PCDM需要与医学监查及其他业务团队讨论和确定数据录入的具体规则以及对最后统计分析结果和CSR报告的影响,并在相关文档中记录决议。

数据管理工作相关方工作概况之医学经理
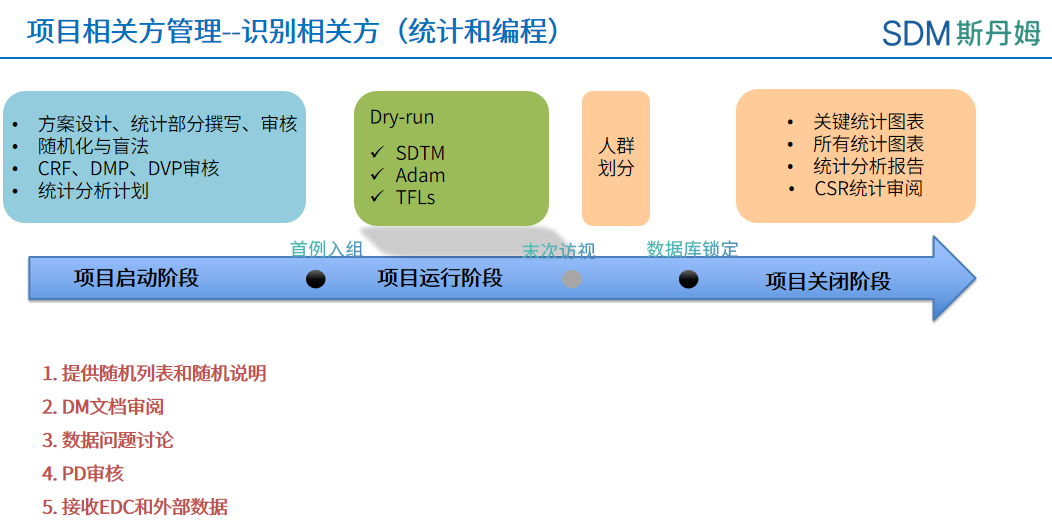
数据管理工作相关方工作概况之统计和编程
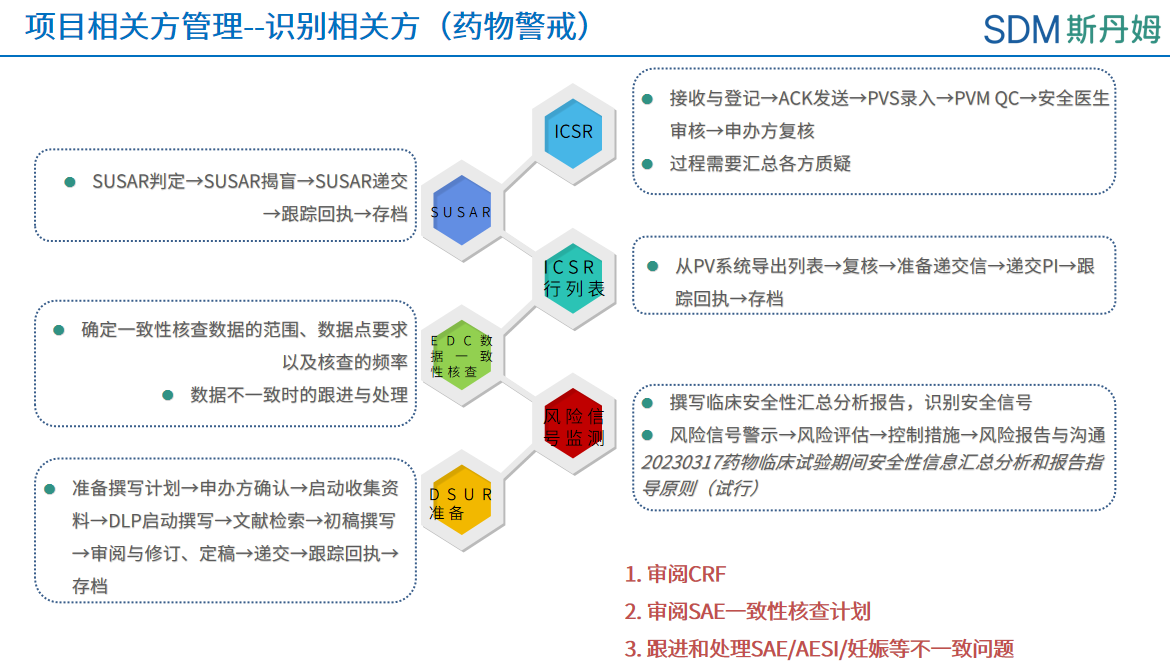
数据管理工作相关方工作概况之药物警戒
申办者作为数据质量最终的负责人,PCDM应在项目初期和申办者进行沟通,辨识并确认申办者的服务需求以计划和安排各项数据管理活动,以避免PCDM按照自己的思维定式开展工作,而未达成项目预期。项目实施阶段PCDM应向申办者汇报项目进展情况,并就关键问题(如EDC系统选择、编码词典版权等)向申办者寻求意见,申办者则需要按照之前达成的共识进行相关文件审阅、数据库测试和项目关键问题的讨论与确认。在合作过程中,PCDM需注意沟通方式,应从专业角度尽量向申办者提供建议请其确认,减少让申办者做选择题、判断题甚至问答题的情况。
当PCDM遇到专业相关或沟通不顺利等问题时,可向直线经理寻求帮助或申请介入,以免因为担心影响个人表现而延误了项目解决问题的关键时间。直线经理日常也应尽量参加项目会议,审阅项目邮件,必要时支持项目问题讨论。
规划和管理相关方参与
规划相关方参与是根据相关方的需求、期望、利益和对项目的潜在影响,制定项目相关方参与项目的方法的过程。相关方参与度可分为5个类型:不了解型、抵制型、中立型、支持型、领导型[1]。在合作和沟通遇到阻力时,PCDM应先调查问题的来龙去脉,站在相关方的角度评估各方的期望以及对于该事件的参与度,选择合适的沟通方式和解决策略,不能一味陷入自己的立场中,强调自己想达成的目标,反而使问题陷入僵局。

管理相关方参与是与相关方进行沟通和协作以满足其需求与期望、处理问题,并促进相关方合理参与的过程[1]。通常各种相关方对于同一问题的理解、期望与需求各有不同,在合作过程中出现矛盾或冲突是在所难免的,以下为常见的五种冲突解决方法:撤退/回避、缓和/包容、妥协/调解、强迫/命令、合作/解决问题,可以为我们处理冲突提供一些思路。
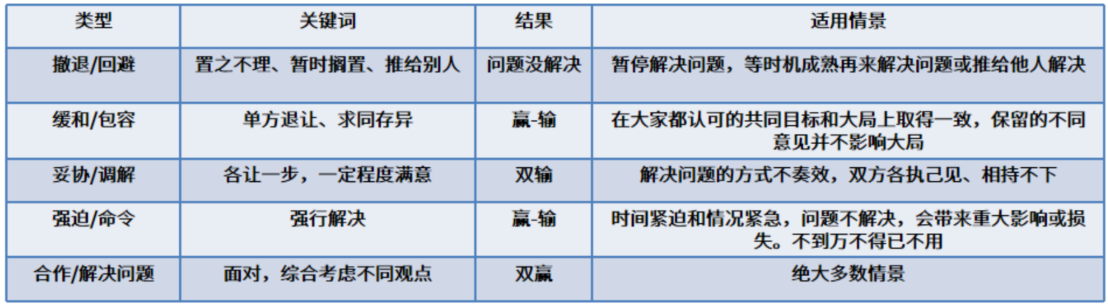
在临床试验实施过程中,PCDM常常需要针对数据问题组织多个相关方一起讨论。例如对于疫苗临床试验的CRF设计,各业务部门都有自己的思考角度。PM日常和研究者及CRA沟通频繁,在审阅CRF时常常会站在研究者的角度,会考虑现场运营流程、研究中心SOP以及研究者的录入习惯,希望CRF的设计能尽量给研究者的录入工作提供便利,也能方便CRA查阅原始资料进行SDV;医学监查出于医学的角度,尽可能细致地在数据层面把控受试者的安全性信息,所以希望更多详细的不良事件信息都能录入到EDC中进行数据核对,如疫苗试验接种后每日腋温、腹泻次数、呕吐次数、具体急性过敏反应症状,但同时,更多的数据收集不仅会带来工作量,也会带来数据核查和清理的风险;EDC数据收集的主要目的是进行后期统计分析,统计编程的同事希望收集进来的数据可以符合CDASH标准,能顺利进行编程相关工作。
PCDM在组织CRF设计讨论时,可借助表1提前对相关方的参与度进行判断,了解不同相关方的考量点,以及意见出现冲突时各方顾虑的背景和原因,在符合指导原则、行业准则和公司SOP的基础上综合项目整体需求进行协商和建议,不能一味强调某一方的角度和观点而做出判定,导致增加人力消耗或增加项目风险。
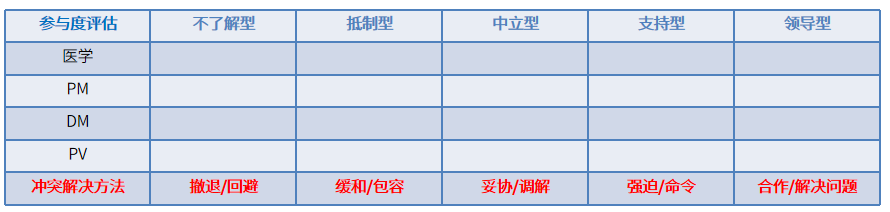
表1 临床试验相关方参与度评估表
参考文献:
[1] :项目管理知识体系指南(PMBOK® 指南)第六版
更新后的指南草案涉重点关注临床试验设计、监管考虑,以及这些试验是否能够证明药物能够维持根据BMI确定的减肥效果。
在前面三期的临床数据管理“PM”养成系分享内容中我们介绍了三个主题内容:明确临床试验各方职责范围划分的项目范围管理;运用公司及个人资源以完成数据管理工作的项目资源管理;如何通过制定时间线计划和进度跟进以完成项目重要里程碑事件的项目进度管理。这期我们分享的是兼顾项目管理与项目可交付成果两个方面的项目质量管理。
我们一起来回顾下前两次分享的临床数据管理“PM”养成系列的内容:首先是明确临床试验各方职责范围划分的项目范围管理,然后是运用公司及个人资源以完成数据管理工作的项目资源管理。这一期我们会针对项目管理的重头戏—项目进度管理来展开数据管理活动时间线计划和进度跟进的内容分享,在保证数据质量的前提下高效完成数据管理相关工作以达成项目重要里程碑事件。
在上一期的分享中,我们一起学习了数据管理工作相关的项目范围管理,分别识别了数据清理和数据管理活动的各方职责范围划分。在确定数据管理工作范围后,这一期我们一起学习如何调动工作范围内的相关资源,来更高效、更高质量地展开数据管理相关工作。
上海斯丹姆疫苗数据管理部联合国际项目部共同开展《项目管理知识在数据管理工作中的应用》主题系列培训。《项目管理知识在数据管理工作中的应用》包含项目整合管理、项目范围管理、项目进度管理、项目质量管理、项目资源管理、项目沟通管理、项目风险管理、项目相关方管理等八个模块内容,主要参考项目管理知识体系指南(PMBOK指南)的理论知识,并结合数据管理工作内容和项目实践经验进行展开。