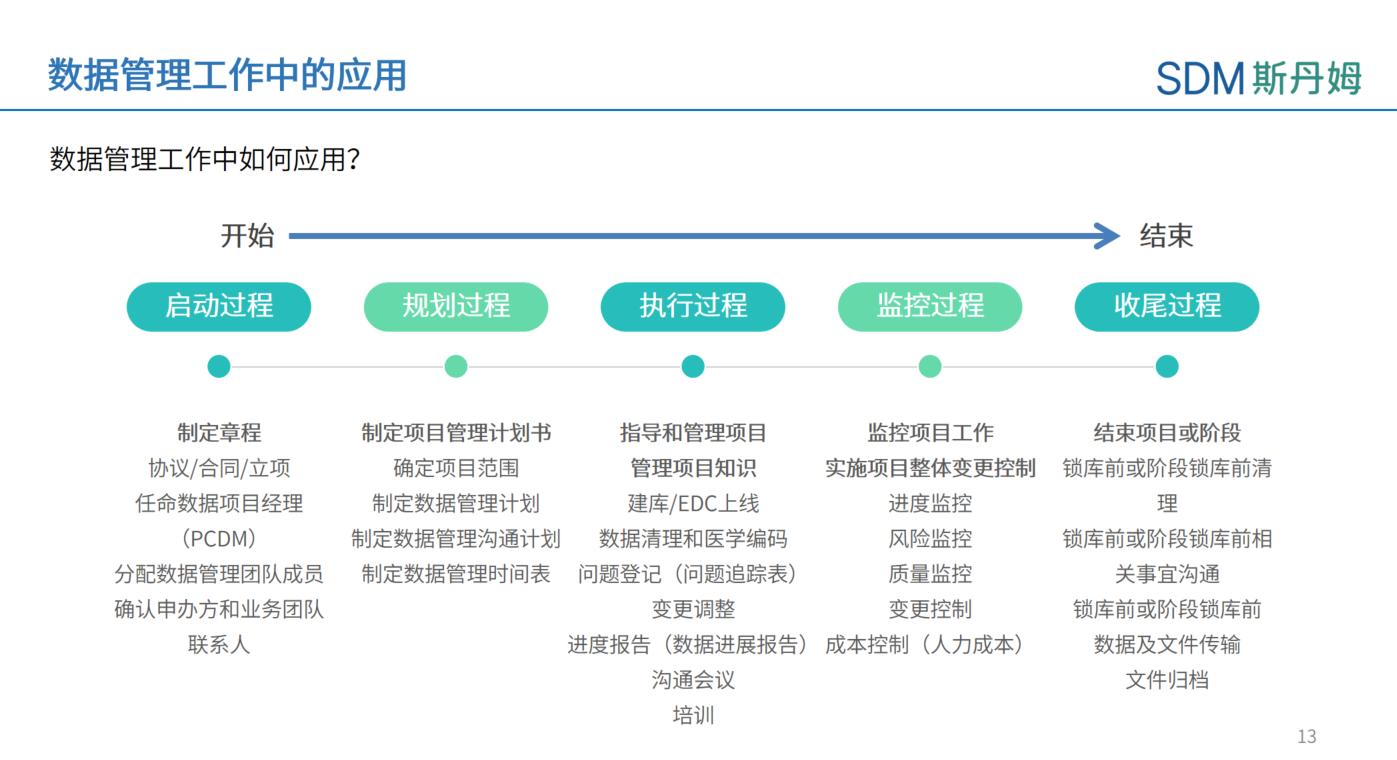
数据管理工作(Data Management)伴随着整个临床试验周期展开,数据管理员(Data Manager)也需要运用项目管理知识对日常数据管理相关工作进行计划、执行、监管和质量控制。上海斯丹姆疫苗数据管理部联合国际项目部共同开展《项目管理知识在数据管理工作中的应用》主题系列培训。《项目管理知识在数据管理工作中的应用》包含项目整合管理、项目范围管理、项目进度管理、项目质量管理、项目资源管理、项目沟通管理、项目风险管理、项目相关方管理等八个模块内容,主要参考项目管理知识体系指南(PMBOK指南)的理论知识,并结合数据管理工作内容和项目实践经验进行展开。

主要数据管理员(Principle Clinical Data Manager)在数据管理工作中是近似于项目经理的角色,需要计划整个临床试验周期全流程End to End数据管理相关工作。在计划阶段,主要数据管理员要组建团队,确认相关方,计划建库时间线,在试验开展过程中,需要全程监控项目数据健康状态,评估风险,定期召开会议和相关方讨论和解决数据问题,并做好数据文档、EDC和数据清理的质量管理工作。综上,能够从时间进度,项目风险,相关方沟通,质量控制等方面全方位规划和执行数据管理工作,才是一名出色的数据管理员。

首先我们先了解一下何为项目范围管理。项目范围管理包括确保项目做且只做所需的全部工作,以成功完成项目的各个过程。管理项目范围主要在于定义和控制哪些工作应该包括在项目内,哪些不应该包括在项目内。[1]所以在做好范围管理时我们需要思考三大点:对方需求是什么?我们需要做什么?怎么做?
项目范围管理在数据管理工作中的应用主要有数据管理活动职责划分和数据核查范围划分两个部分。
临床试验数据管理过程中往往涉及到多项工作和多方人员。为了更好地进行工作的管理,项目初始阶段主要数据管理员应知晓各数据管理活动所涉及的人员及其职责,因此需要制定相应的RACI表,其中 R 表示谁负责(Responsible)、A 表示谁批准(Accountable)、C 表示咨询谁(Consulted)和 I 表示通知谁(Informed)。RACI表中可规定数据管理工作启动、实施和结束各阶段中各项活动及人员的职责属性。下图展示为数据管理工作中RACI图样稿:
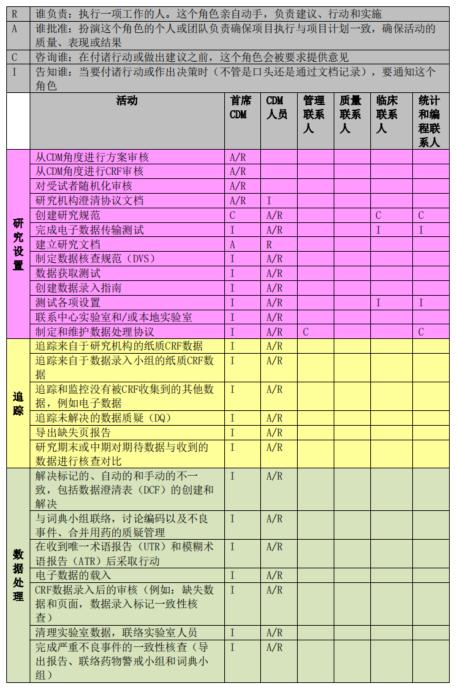
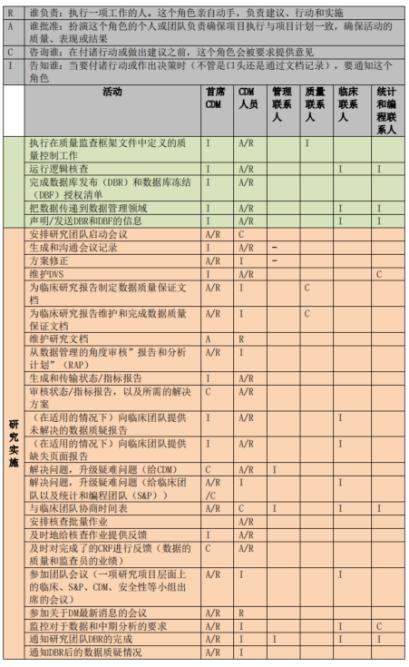
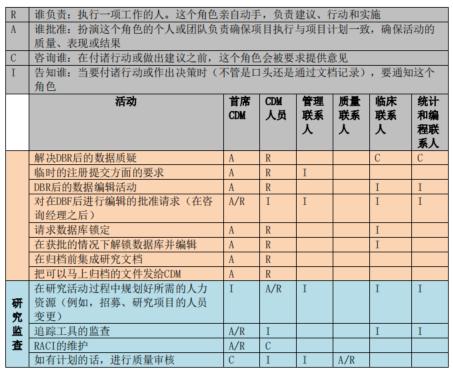
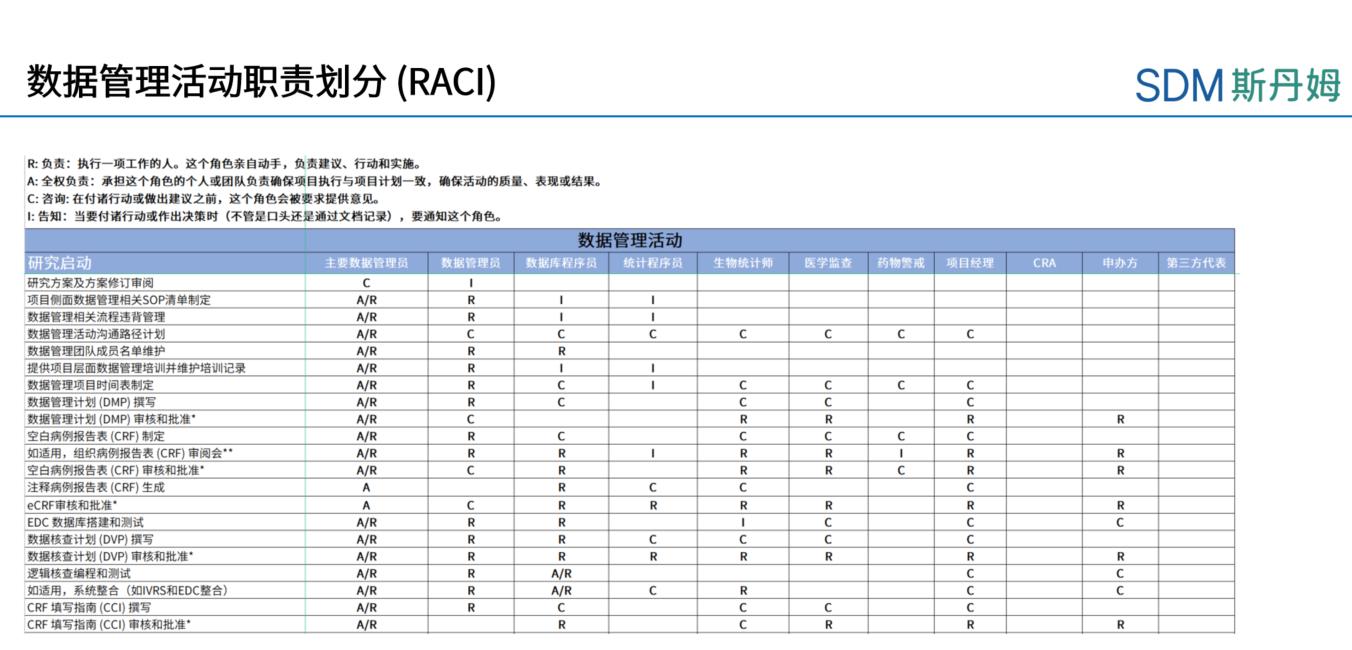
上海斯丹姆疫苗数据管理部RACI图例
项目开展后,主要数据管理员应根据RACI表开展每一项数据管理活动,并咨询或告知相关方。如RACI表格中定义的是A或者R,则相应角色需执行文档审阅和批准,系统测试和反馈,并对该项工作负责;如表格中定义的是C或I,则主要数据管理员应在文档审阅或批准时咨询或告知相关方。所有相关方也需要提前审阅RACI表格以明确自己需要履行的职责。
同时,对于数据管理团队内部也应该界定清楚各成员职责,如主要数据管理员、数据管理员(Clinical Data Manager)、建库专员(Database Designer)、SAS编程员(SAS Programmer)、编码专员(Coder)以及非盲数据管理员,并明确各方工作范围及合作方式。
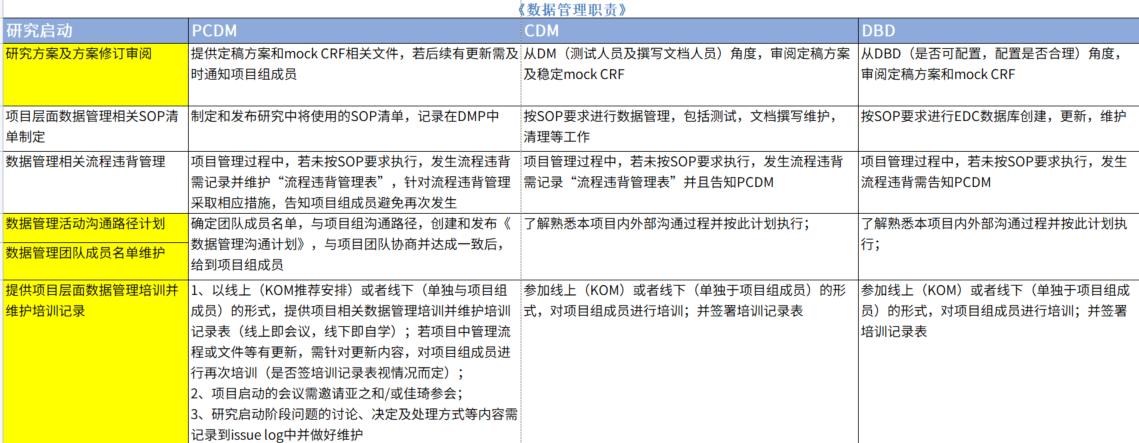
上海斯丹姆疫苗数据管理部《数据管理职责》图例
当然,临床试验复杂多变,无论文件描述多详细,在项目开展过程中也可能遇到没有提前界定的问题,我们以账号管理为例来进行说明。
XXX项目由于启动时间紧张,IRT系统和EDC系统没有对接。系统上线后一段时间,数据管理员偶然发现有几名人员在IRT系统里申请的是非盲药剂师账号,但是在EDC系统里申请的是盲态CRA账号,并且已经在EDC中开始做SDV和发CRA query。数据管理员迅速报告给了项目组,由于非盲人员不能再进行盲态角色相关操作,项目组决定失活以上人员的盲态账号。为防止此类事件再次发生,数据管理员是否应该在每一次收到账号申请时对EDC和IRT账号信息进行质量控制?
根据《药物临床试验盲法指导原则》,根据临床试验确定的盲法,应对每位研究参与人员细化职责分工,按照其岗位授权要求划分为盲态保持人员和非盲态保持人员。应采取严格措施在盲态保持人员和非盲态保持人员之间设定“防火墙”,以避免意外破盲[3]。
IRT和EDC系统须有完善的权限管理设置,包括角色设置、工作流设置和授予权限等,数据团队需制定SOP进行系统权限控制与管理。对系统中不同人员或角色授予不同的权限,只有经过授权的人员才允许操作(如记录、修改等),并应采取适当的方法来监控和防止未获得授权的人的操作[4]。在项目进行中,收集各方成员的系统权限需要PM与数据管理员紧密配合。建议在收集账号时由了解临床试验各方人员分工的PM或其指派人员(各方代表)进行第一次账号申请质控,确认人员角色、申请权限是否与系统权限相匹配。数据管理员在收到PM确认后的权限申请表时,可协助核对多个系统间申请的权限是否存在不一致的情况。
临床试验数据的收集和清理需要各部门之间的紧密配合,各部门需从不同角度对数据进行审阅和质疑。数据管理员根据《数据核查计划》进行核查,常规包含但不限于:缺失值核查、eCRF页面缺失核查、范围核查、重复值核查、同一eCRF页面的逻辑一致性核查、不同eCRF页面的逻辑一致性核查、外部数据核查、SAE一致性核查、方案偏离等。CRA需保证EDC数据与原始文件一致,保证数据的准确性和可溯源性。医学监查员可从安全性和医学角度对临床试验数据进行核查,从而保护受试者的权益和从医学角度保障临床试验数据的可靠性,同时也对临床试验相关步骤提供医学相关建议。
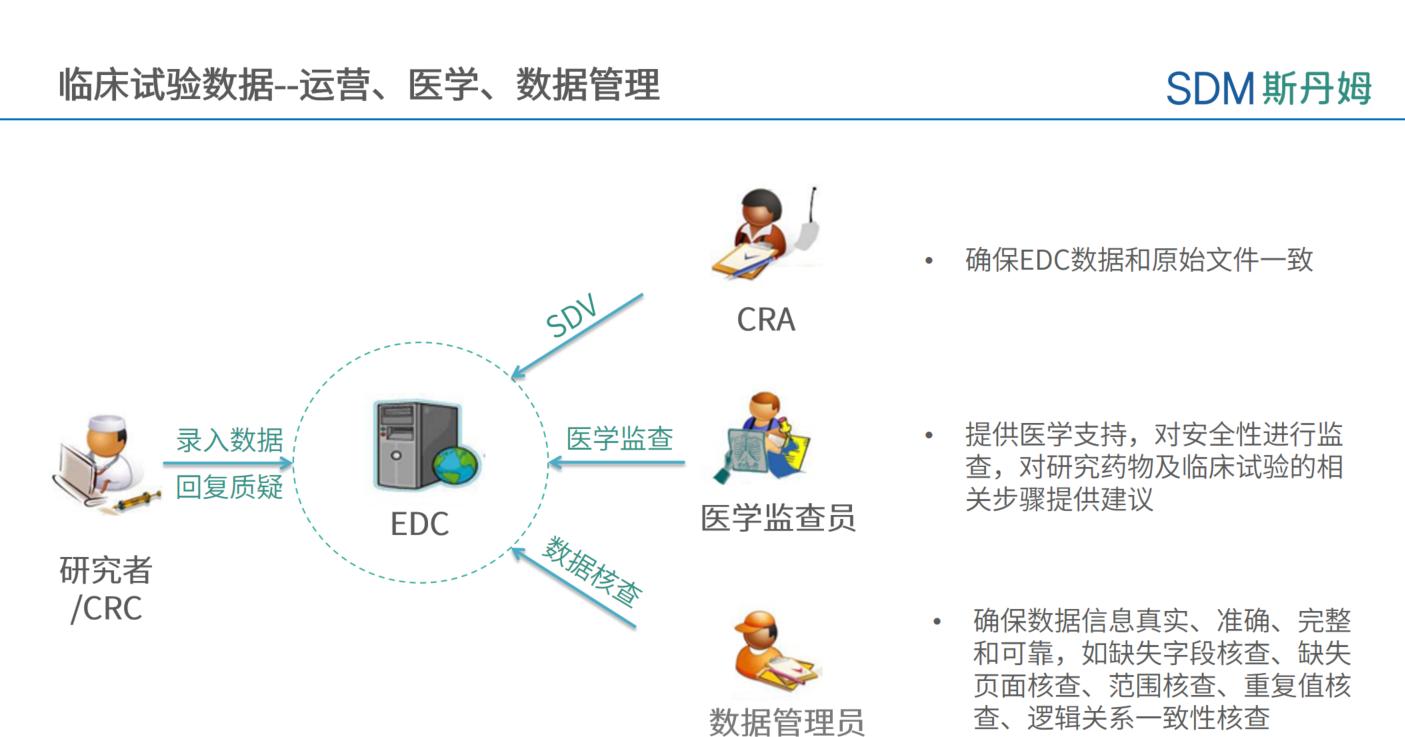
为了更高效地进行数据清理,可在公司层面起草iDRP(integrated Data Review Plan)来界定医学、数据、运营三方核查范围,以避免数据点查漏、查重。核查范围可包含下图中表单:

《上海斯丹姆疫苗项目医学数据运营核查范围》主要包含表单
举例说明,针对不良事件(Adverse Event, AE)表单,由医学监查员完成涉及医学知识判断的核查,如多个数据点的合理性判定:包含AE与合并药物/非药物治疗关联、AE相关性判断、AE分级判定、AE名称记录、AE对试验用疫苗的处置;潜在重复AE;中止试验的主要AE等。数据管理员对有固定逻辑的内容进行一致性核查,包括但不限于:AE与研究总结、AE与相关联合并药物/非药物治疗的时间窗、实验室AE与实验室检查结果、SAE一致性、转归与结束日期等。数据管理员针对疫苗项目还需额外进行征集性与非征集性、接种部位与非接种部位、接种剂次、征集时间窗的合理性核查;征集期内诊断和症状记录的拆分合理性;征集期内发热与AE的双向核查;征集期内局部AE与试验疫苗的相关性核查等。

方案偏离(Protocol Deviation, PD)也需要多方合作进行收集和核查。运营团队收集并核查项目层面汇总的《方案偏离列表》。医学监查员审核PD,并判断其分类。数据管理员通过逻辑核查发现并记录潜在PD,并发送至运营团队和医学监查员确认是否存在漏报PD的情况。在项目重要节点(期中分析或最终锁库)时,数据管理员应将《方案偏离列表》与EDC数据进行一致性核查。

项目范围管理的明确和划分,可以让专业的人做专业的事,项目团队各司其职、一起紧密配合、更高效地交付更好的项目成果。
参考文献:
[1]:项目管理知识体系指南(PMBOK® 指南)第六版
更新后的指南草案涉重点关注临床试验设计、监管考虑,以及这些试验是否能够证明药物能够维持根据BMI确定的减肥效果。
在前面三期的临床数据管理“PM”养成系分享内容中我们介绍了三个主题内容:明确临床试验各方职责范围划分的项目范围管理;运用公司及个人资源以完成数据管理工作的项目资源管理;如何通过制定时间线计划和进度跟进以完成项目重要里程碑事件的项目进度管理。这期我们分享的是兼顾项目管理与项目可交付成果两个方面的项目质量管理。
我们一起来回顾下前两次分享的临床数据管理“PM”养成系列的内容:首先是明确临床试验各方职责范围划分的项目范围管理,然后是运用公司及个人资源以完成数据管理工作的项目资源管理。这一期我们会针对项目管理的重头戏—项目进度管理来展开数据管理活动时间线计划和进度跟进的内容分享,在保证数据质量的前提下高效完成数据管理相关工作以达成项目重要里程碑事件。
在上一期的分享中,我们一起学习了数据管理工作相关的项目范围管理,分别识别了数据清理和数据管理活动的各方职责范围划分。在确定数据管理工作范围后,这一期我们一起学习如何调动工作范围内的相关资源,来更高效、更高质量地展开数据管理相关工作。
上海斯丹姆疫苗数据管理部联合国际项目部共同开展《项目管理知识在数据管理工作中的应用》主题系列培训。《项目管理知识在数据管理工作中的应用》包含项目整合管理、项目范围管理、项目进度管理、项目质量管理、项目资源管理、项目沟通管理、项目风险管理、项目相关方管理等八个模块内容,主要参考项目管理知识体系指南(PMBOK指南)的理论知识,并结合数据管理工作内容和项目实践经验进行展开。