在前面三期的临床数据管理“PM”养成系分享内容中我们介绍了三个主题内容:明确临床试验各方职责范围划分的项目范围管理;运用公司及个人资源以完成数据管理工作的项目资源管理;如何通过制定时间线计划和进度跟进以完成项目重要里程碑事件的项目进度管理。这期我们分享的是兼顾项目管理与项目可交付成果两个方面的项目质量管理。
项目质量管理包括把组织的质量政策应用于规划、管理、控制项目和产品质量要求,以满足相关方目标的各个过程。规划质量管理过程关注工作需要达到的质量,管理质量则关注管理整个项目期间的质量过程,控制质量关注工作成果与质量要求的比较,确保结果可接受[1]。临床试验数据的质量不仅直接影响试验结果的准确性和可靠性,更关系到研究报告,以及整个临床研究的结论。所以对于临床数据管理活动,实施质量管理是必须进行的重要工作。
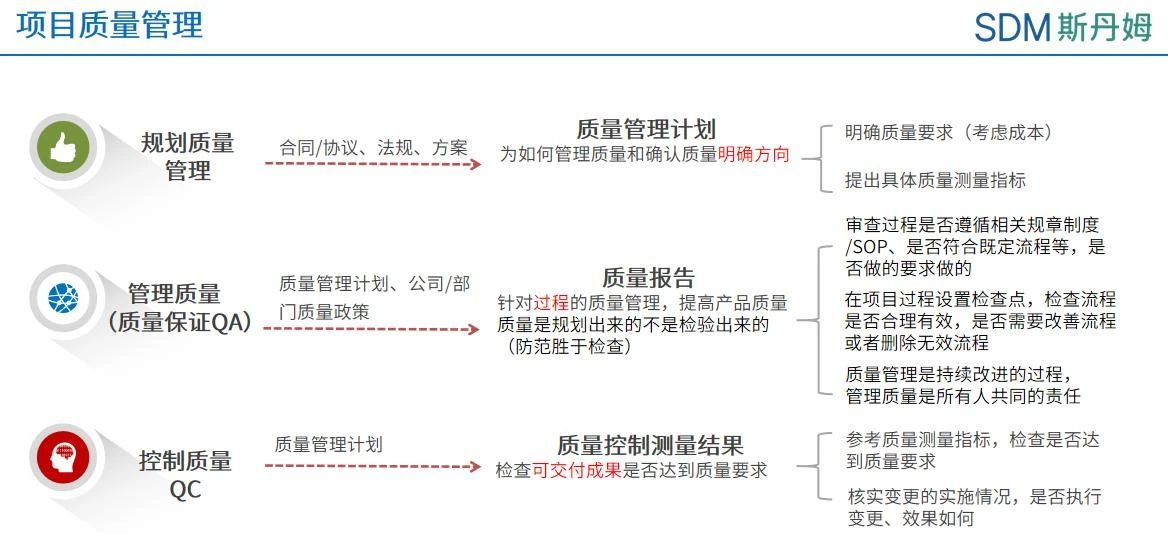
数据管理工作中的质量保证
从公司层面,需有完备的标准作业程序(SOPs,Standard Operating Procedure)来指导各数据管理活动的操作规范性,同时须有完整的职位职责描述、完善的培训体系确保各项工作任务的要求被更准确的传达。此外,还可搭建质量标准体系和标准库体系来进行工作的规范性指导。

跨项目质量控制
“不识庐山真面目,只缘身在此山中”,即便数据管理员(DM,Data Manager)经历过完善的培训且具有丰富的数据管理经验,在日常工作中数据管理质量也会受限于固有的工作习惯或长期专注于某一治疗领域的思考视角,从而导致忽略了一些数据管理问题,所以数据管理质控工作需要定期从旁观者的角度来考察项目工作中存在的问题和风险。因此跨项目的质量控制是质量管理体系中不可或缺的一部分。安排非项目组内的成员进行质量控制,可以避开项目组内成员的思维固定化限制进而识别项目工作潜在的错误点或者风险点。
跨项目质量控制可由公司的质控部门或数据部门组建的质控小组制定年度质量控制计划并开展质控工作。如遇项目关键里程碑如中期分析,主要数据管理专员(PCDM,Primary Clinical Data Manager)也可以在项目层面向质控小组提出质控需求。
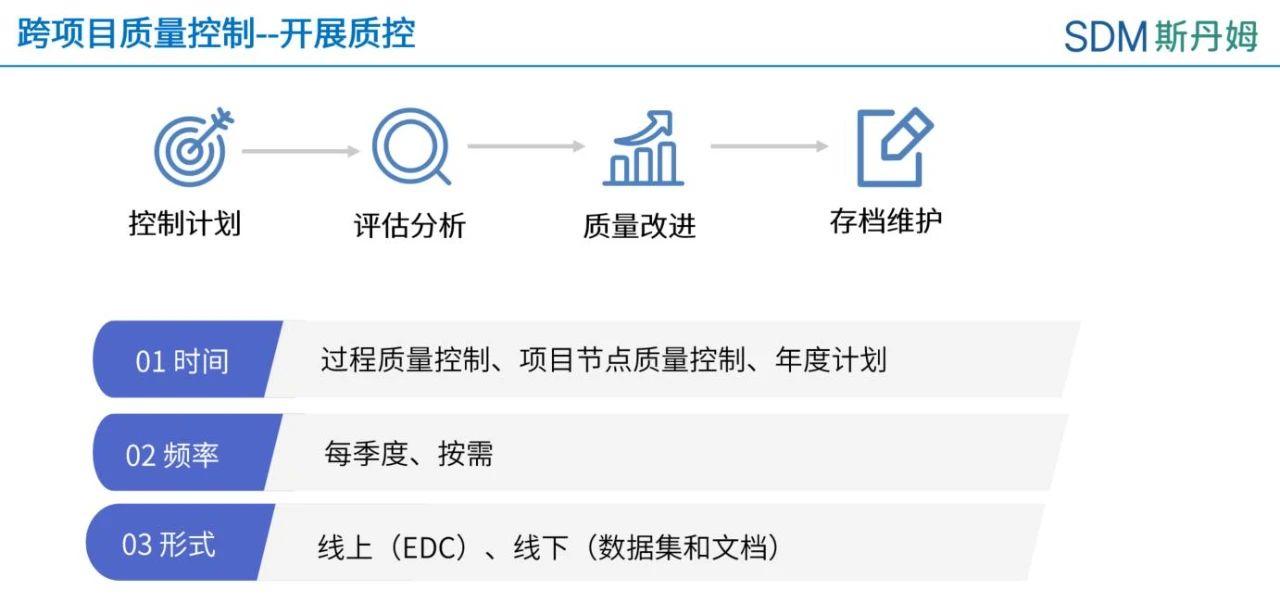
质量小组应有明确的质控范围,通常可从以下5个方面进行计划。
5、《问题跟踪表》(Issue Log):根据质控或项目讨论等是否及时记录问题跟踪表、是否安排成员学习或培训、是否有待解决的遗留问题。
质控小组应对质控发现的问题进行问题等级划分,从项目文档和数据库设计、数据清理、文档合规性核查三个维度来评估问题对整体项目的影响来进行分级。质量分级管理可以帮助项目组一目了然地看到项目的整体质量情况,也便于将项目质量进行横向综合比较。质控结束后,质控小组应出具质量控制报告,督促并跟进PCDM对问题进行回复或整改。下面我们来看看如果质控后遇到质量问题,PCDM该如何解决。

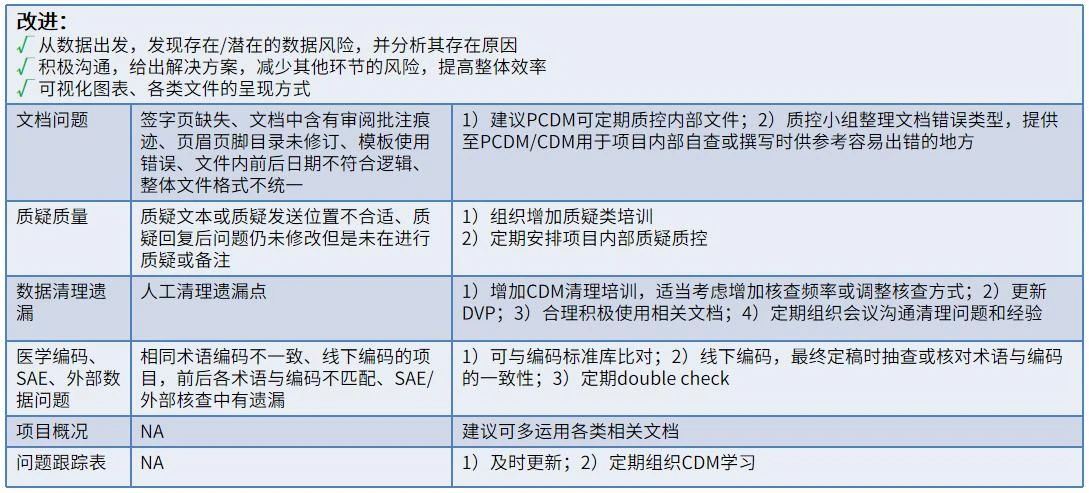
表2 质量控制问题改进措施
项目内部质量控制
项目内部的质量控制由项目PCDM来进行主导,在项目启动、清理和数据库锁定的各个阶段把控项目数据管理活动的质量。
质量源于设计(Quality by Design),就像施工队破土动工前需要一份好的设计图纸一样,数据管理文档撰写和数据库搭建的质量控制是数据管理工作的基础保障。高质量的数据文档和数据库离不开标准库文件的建立。以CRF为例,各表单和字段的设计除了应遵从方案的要求,PCDM还应根据公司层面数据标准库文件的使用指南来设计CRF,如哪些字段为表单内必需字段,哪些可选字段遇何种情况需要添加,哪些字段选项不可以随意更改等。若遇到项目需求和标准库文件使用指南发生冲突,PCDM应按照部门标准库更新流程进行评估,若不能按照标准文件要求设计,PCDM需提出违背标准的相关申请(Standard Request),并交由标准库小组或更高层级的管理者进行审阅和批复。严格的标准库文件执行和维护流程,可以保证项目层面文件较好的交付质量。除了文档设计的合理性,PCDM还应从合规的角度在细节方面把控好所有的数据管理文件,如定稿文件的签字页完整性、文件格式的一致性、页脚的连续性等。
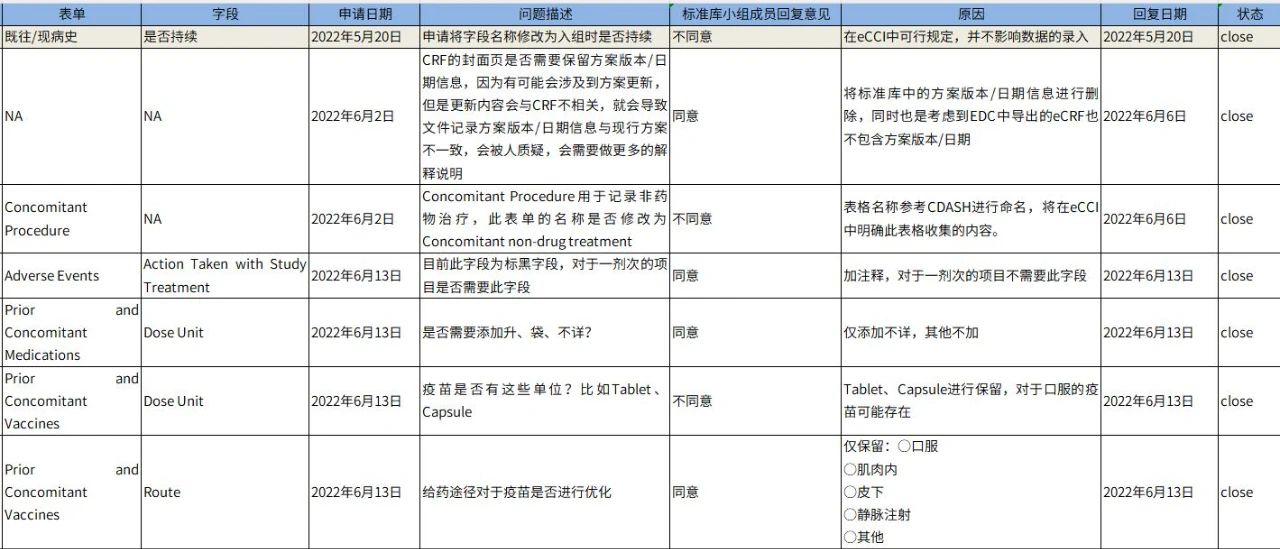
表3 上海斯丹姆标准CRF修改申请表
对于使用临床试验电子数据采集系统(EDC,Electronic Data Capture System)的项目,数据库的测试和质量控制至关重要。PCDM应根据公司层面标准测试流程与测试数据文件以及项目CRF和数据核查计划(DVP,Data Validation Plan)制定项目适用的测试脚本(Testing Script)及测试数据(Testing Data)。测试前DM团队需要给所有参与测试的内外部成员提供测试培训,以保证数据库的每一个数据点、动态、逻辑等得到全面且充分的测试,PCDM应核查测试日志以确保各个测试点没有被遗漏,并维护测试日志的完整性。若方案中不同组别受试者的访视流程有差别(如不同组别受试者接种疫苗间隔时间不同),DM还应在系统上线前针对每个组别创建至少一个受试者以确认该组别适用的访视及表单可以被正确触发。
为避免系统错误触发质疑,在所有测试都通过后DM可考虑将干净数据(Clean Data)录入至EDC中,检查是否会出现错误质疑触发的情况。在保证数据库设计的准确性之外,同时也应考虑提高EDC数据录入的友好性。对于疫苗项目,DM可对照随访本、日记卡等原始资料模拟数据录入,尽量使EDC中的录入顺序符合表卡顺序,以方便现场研究者对照原始资料进行数据录入和CRA进行源数据核查确认(SDV,Source Data Verification)。
在数据清理阶段,PCDM需要对每一个数据清理任务进行质量管理:对于人工核查,PCDM可按照研究中心或表单分配DM的核查任务,并指导组员进行数据核查时在报表上做好标记(如核查过程、质疑结果、质疑文本等),PCDM应及时确认人工核查清单的核查记录来进行留档,并考虑定期交换组内成员分工(如负责清理的中心数据或者表单交换),通过交叉核查避免质疑漏发、错发的情况。对于SAE一致性核查、IWRS一致性核查、PD一致性核查等周期性的工作,PCDM也可采取同样的方式,定期核查或交换组内成员任务进行查漏补缺。
对于质疑管理,PCDM需定期抽查质疑处理的合理性,如是否按照DVP发送质疑、质疑语句内提供信息是否完整、有无诱导性语句、研究者回复数据过段时间才能修改后DM是否进行标记并按时再次进行核查、发送质疑的字段位置是否合适等。对于医学编码,DM团队可考虑联合医学团队搭建公司层面的编码标准库(Coding Convention)以确保不同成员在不同项目中医学编码的一致性,还可通过编程对每一个项目的编码和标准库进行自动化一致性比对,以保证医学编码的质量。
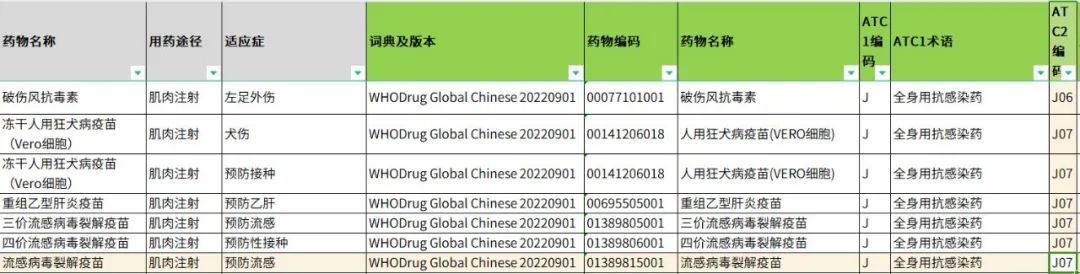
表4 上海斯丹姆疫苗数据管理部医学/药物编码库示例
表5 常见错误来源和主要发现方法[3]
在数据库锁定阶段,PCDM需保证数据清理及数据库锁定进度按照之前项目组达成共识的数据库锁定时间表来进行。在数据库锁定前至少完成一轮数据清理质量控制,若质控结果超出可接受的错误率应立即采取相应解决措施,并尽快开展下一轮质量控制直至确保数据库所有数据达到质量要求,并确保数据库锁定清单上的任务均已完成。数据库锁定后,PCDM需及时进行数据传输以及文档最终的质量控制和归档交付,如在项目运行过程中遇到数据相关SOP违背事件,PCDM应确保所有事件记录于流程违背表中并获得所有相关方签字批准。
参考文献:
[1] :项目管理知识体系指南(PMBOK® 指南)第六版
[2] :药物临床试验数据管理与统计分析的计划和报告指导原则
更新后的指南草案涉重点关注临床试验设计、监管考虑,以及这些试验是否能够证明药物能够维持根据BMI确定的减肥效果。
在前面三期的临床数据管理“PM”养成系分享内容中我们介绍了三个主题内容:明确临床试验各方职责范围划分的项目范围管理;运用公司及个人资源以完成数据管理工作的项目资源管理;如何通过制定时间线计划和进度跟进以完成项目重要里程碑事件的项目进度管理。这期我们分享的是兼顾项目管理与项目可交付成果两个方面的项目质量管理。
我们一起来回顾下前两次分享的临床数据管理“PM”养成系列的内容:首先是明确临床试验各方职责范围划分的项目范围管理,然后是运用公司及个人资源以完成数据管理工作的项目资源管理。这一期我们会针对项目管理的重头戏—项目进度管理来展开数据管理活动时间线计划和进度跟进的内容分享,在保证数据质量的前提下高效完成数据管理相关工作以达成项目重要里程碑事件。
在上一期的分享中,我们一起学习了数据管理工作相关的项目范围管理,分别识别了数据清理和数据管理活动的各方职责范围划分。在确定数据管理工作范围后,这一期我们一起学习如何调动工作范围内的相关资源,来更高效、更高质量地展开数据管理相关工作。
上海斯丹姆疫苗数据管理部联合国际项目部共同开展《项目管理知识在数据管理工作中的应用》主题系列培训。《项目管理知识在数据管理工作中的应用》包含项目整合管理、项目范围管理、项目进度管理、项目质量管理、项目资源管理、项目沟通管理、项目风险管理、项目相关方管理等八个模块内容,主要参考项目管理知识体系指南(PMBOK指南)的理论知识,并结合数据管理工作内容和项目实践经验进行展开。