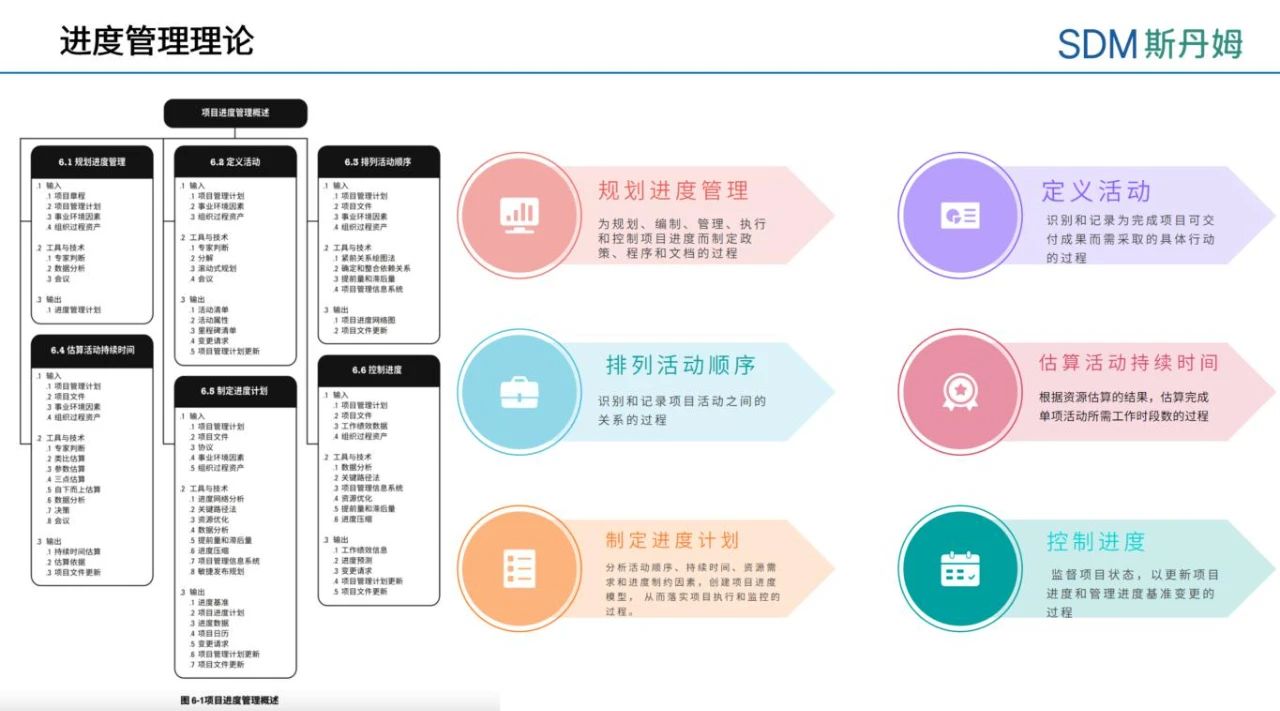
项目进度管理包括为保证项目按时完成所需的各个过程,包括6大过程:规划进度管理、定义活动、排列活动顺序、估算活动持续时间、制定进度计划和控制进度。“凡事预则立,不预则废”,其中制定进度计划是项目管理尤为重要的环节。进度计划用来提供详尽的计划,说明项目如何以及何时交付项目范围中定义的产品、服务和成果,是一种用于沟通和管理相关方期望的工具,为绩效报告提供了依据。在可能的情况下,应在整个项目期间保持项目详细进度计划的灵活性,使其可以随着知识的获得、对风险理解的加深,以及增值活动的设计而调整[1]。
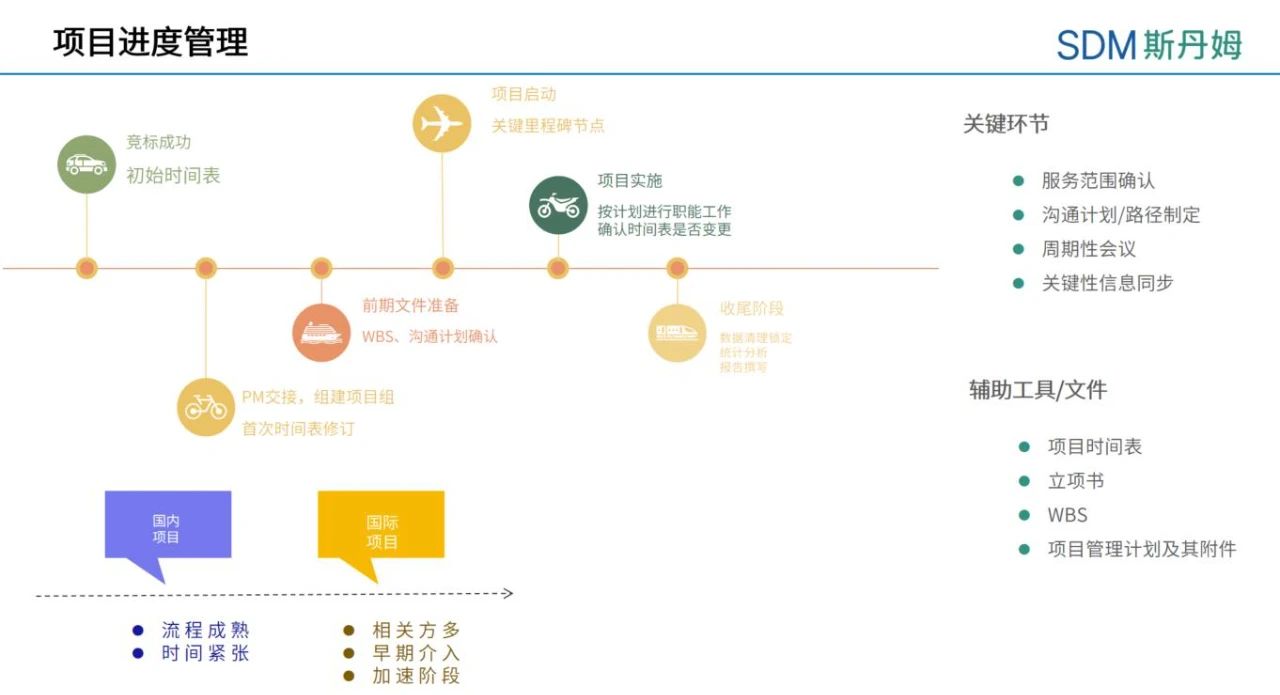
对于临床数据管理活动而言,制定时间线计划同样至关重要。接下来,我们会从数据管理活动的三个阶段项目启动、清理和数据库锁定来介绍制定时间线计划和跟进项目进度的主要考量因素。
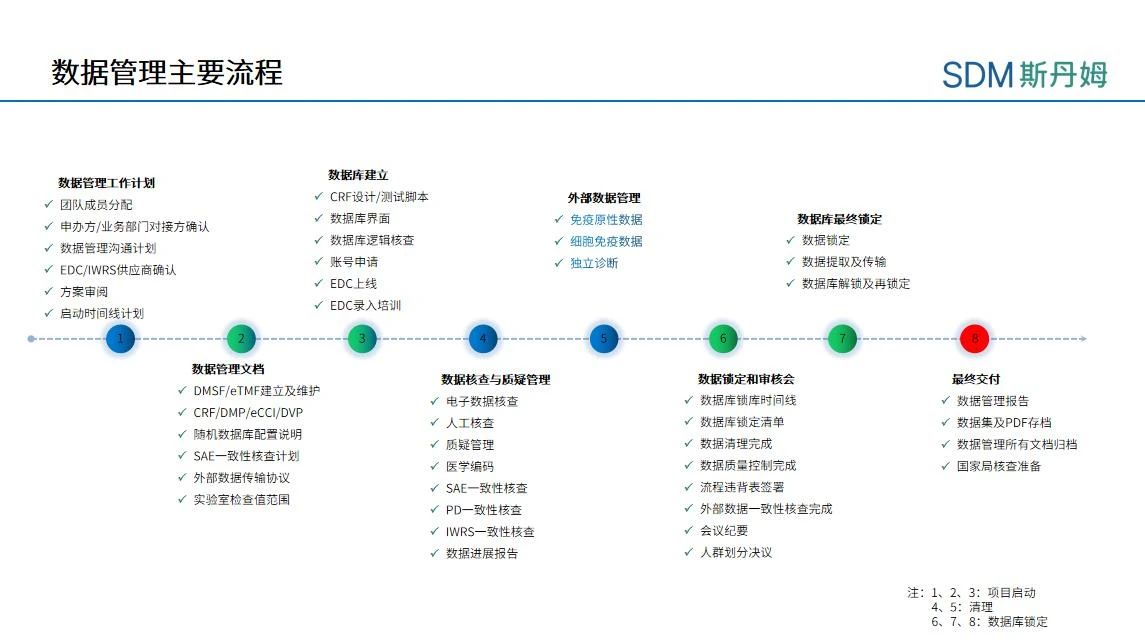
数据管理主要流程(以疫苗项目为例)
在项目早期准备阶段,数据管理团队就可以开始介入临床试验相关的工作了,除了审阅方案、组建团队、确认EDC/IWRS系统选择外,还应针对项目需求给出数据管理工作的重难点分析及解决方案,根据项目经理制定的初始《项目时间表》提供数据管理活动时间线安排的反馈,以及准备项目《数据管理沟通计划》。初始《项目时间表》在后续项目进展中需要根据项目需求和实际项目推进情况进行调整,例如:对于数据管理活动而言,EDC的选择会影响建库时间线的安排。如果项目打算启用新的EDC,需要提前确认建库方、梳理系统功能设置、安排相应培训。且为了熟悉新系统操作,用户接受测试(UAT,User Acceptance Testing)也需要多预留一些时间给项目组。
同时也要格外留意系统账号管理和工作流的设置对项目的影响,若必要可考虑添加新的文件模板等进行管理。若项目采用随机系统进行随机和发药,还应提前和项目经理或供应管理经理确认药品供应计划的准备时间,也应明确随机系统中各项职责分别由哪些相关方担任,特别需要留意盲态和非盲态角色的配置。
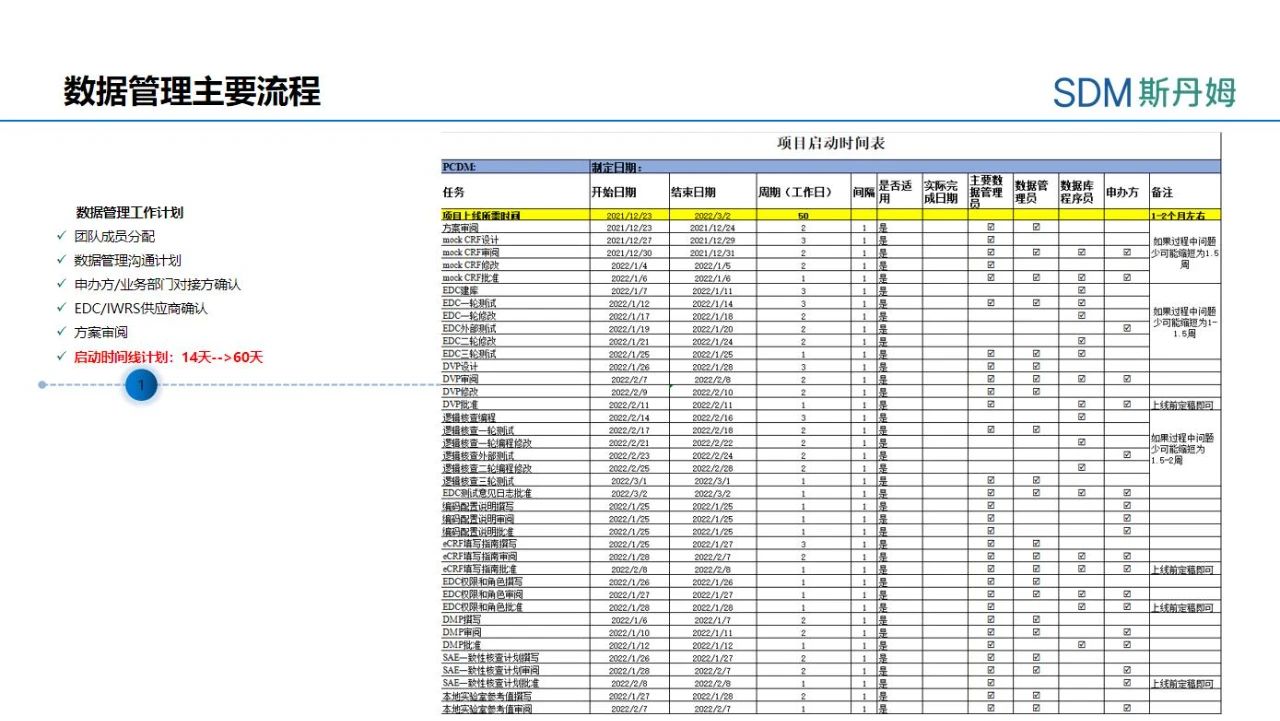
启动前的工作的影响因素
对于整个项目而言,启动阶段的关键里程碑事件即为首例受试者入组,EDC系统需要在首例受试者入组前完成上线工作。以疫苗试验为例,启动阶段的限速步骤通常有获取临床试验批件、疫苗检定、方案定稿、基地评估和考核、研究中心合同签署、伦理批准等。CRF的撰写和数据库建库会以方案定稿为起点,一般不会成为影响项目运行的限速步骤,数据管理团队在首例受试者入组前完成EDC/IWRS系统的上线工作即可。但是为了可以更好地协调项目资源,做为数据管理员我们也可以多了解一些影响到项目启动的运营相关的因素,以更好地安排数据管理活动时间线。比如有些EDC系统在上线后才开始计费,PCDM可以根据项目整体进度合理规划系统上线时间,以减少额外费用的产生。
临床试验前期,行政审批通常需要花费较长时间,启动前常见项目进度的影响因素见表一,如临床批件申请及申办者与国家药品监督管理局药品审评中心(CDE,Center for Drug Evaluation)的沟通;如伦理审批,通常在医院开展的临床试验,需要提前确认伦理会议频率与周期,立项伦理流程总体周期较疾控中心获得伦理批件的时间周期长,涉及遗传办备案的项目,还需在获得伦理批件与各方合同签署后才可进行备案。对于海外临床试验,由于各个国家情况不同,获得药监批件同样是主要的限速步骤,有时从申请到批准的时间较长,但一旦获得批件后,整个项目即可进入加速准备阶段,数据文档的准备和数据库建库测试需要快速启动和完成。有别于国内疫苗临床试验,海外试验的时间线还会受到疫苗及其他物资出口、运输、海关清关、航班情况、研究者配合度等多方面因素影响。

表一:启动前常见项目进度的影响因素
数据库上线后,数据管理员需按照数据管理计划(DMP,Data Management Plan)中规定的频率进行各项数据管理活动:数据清理、质疑管理、医学编码、严重不良事件一致性核查、方案偏离处理、外部数据一致性核查、质量控制、数据进展报告撰写等,工作节奏和任务会相对比较平稳。在项目平稳期时,PCDM需针对以下三个方面对数据管理相关进展进行监测和问题跟进:
1、建议按每月的频率跟进项目重点数据绩效指标的情况,如SDV比例、页面录入率、访视发生至数据录入的平均时长、质疑回复率、一次性关闭质疑率、SAE一致性核查问题数目等,并及时和项目组对出现风险的绩效指标进行沟通,对诸如滞留大量质疑、SDV比例低等问题进行原因分析和解决方案制定,将数据录入风险控制在平时,以避免数据问题堆积在期中分析或数据库锁定时增加项目组压力或导致项目时间线推迟;
3、对于时间较长样本量较大的项目,PCDM应根据入组计划和方案流程(SoA)对数据录入量进行预判,合理地安排人力资源支持数据清理工作。PCDM可以根据访视安排和DMP中对于数据录入(访视到录入的时限要求)计算每个月的录入访视数并做出访视曲线,以规划和调整数据核查人员。无论是否有时间节点,建议至少每两周处理一次质疑,每个月完成一次人工核查,以避免数据问题因太久未被核查和质疑而导致研究者无法追踪原始记录对问题数据进行更新或澄清。
关于数据库上线后EDC系统变更,通常有两种情况可能导致改库。
一、系统需进行更新,之前设置的系统有需要进行优化的地方,如CRF设计需优化(合并用药添加新的单位)、逻辑核查配置有误等;
二、方案进行变更且其变更对CRF造成影响。对于系统的变更,PCDM应对变更流程进行严格控制,首先与项目组确认变更的内容和数据库变更时间线,根据系统特性评估是否会出现因数据库变更而需要暂停使用的情况,如必要,应提前和项目团队及研究者进行沟通,另外PCDM还需要与建库专员(DBD,Database Designer)评估改库对现有数据的影响,以确保原有数据无损,且应尽量避免因为数据库变更而导致需要大量重新录入数据的情况发生。PCDM应对于变更内容在相关文档上进行详细记录,并对变更后的系统进行充分测试和数据迁移比对。
在数据库锁定阶段,PCDM需提前制定数据库锁定时间表并和项目组对于数据清理时间线的安排达成一致。数据库锁定的数据管理活动是一环扣一环的,每一轮的数据清理工作需要按源数据核查确认(SDV,Source Data Verification)、医学审核和人工核查、质疑处理的顺序来进行,一般数据库锁定前安排3轮人工核查基本可完成所有数据的清理工作。所以数据库锁定时,PCDM不仅需要关注DM内部的工作完成情况,还需与项目组保持密切沟通,确保研究中心人员能够按时完成数据录入及质疑解答、运营部门可按时完成SDV工作、医学监查团队按时完成医学审核、第三方供应商及时回传外部数据和解决数据问题、研究者(PI,Principal Investigator)按时完成系统电子签名、统计部门完成统计分析计划(SAP,Statistical Analysis Plan)的定稿等。所以在数据库锁定阶段,PCDM不仅要提前规划时间线,如遇假期还应提前和项目组及研究中心确认休假和Back-up成员安排,以避免因人员缺席导致项目进度延迟,数据库锁定期间PCDM还应密集向项目组告知时间表完成情况及潜在影响最终锁定的风险,必要时可每天沟通一次。

综上,PCDM如果想管理好项目进度,应把握好四个关键动词:
学习--仔细地学习整个临床试验方案以了解重要项目节点;
沟通--和项目组及时地进行双向沟通以了解项目相关进展和使项目组了解数据活动进展;
规划和调整--根据项目需求对数据管理工作进行提前规划和实时调整。
才可以从数据工作的角度更好地支持团队和推进整个项目进展。
更新后的指南草案涉重点关注临床试验设计、监管考虑,以及这些试验是否能够证明药物能够维持根据BMI确定的减肥效果。
在前面三期的临床数据管理“PM”养成系分享内容中我们介绍了三个主题内容:明确临床试验各方职责范围划分的项目范围管理;运用公司及个人资源以完成数据管理工作的项目资源管理;如何通过制定时间线计划和进度跟进以完成项目重要里程碑事件的项目进度管理。这期我们分享的是兼顾项目管理与项目可交付成果两个方面的项目质量管理。
我们一起来回顾下前两次分享的临床数据管理“PM”养成系列的内容:首先是明确临床试验各方职责范围划分的项目范围管理,然后是运用公司及个人资源以完成数据管理工作的项目资源管理。这一期我们会针对项目管理的重头戏—项目进度管理来展开数据管理活动时间线计划和进度跟进的内容分享,在保证数据质量的前提下高效完成数据管理相关工作以达成项目重要里程碑事件。
在上一期的分享中,我们一起学习了数据管理工作相关的项目范围管理,分别识别了数据清理和数据管理活动的各方职责范围划分。在确定数据管理工作范围后,这一期我们一起学习如何调动工作范围内的相关资源,来更高效、更高质量地展开数据管理相关工作。
上海斯丹姆疫苗数据管理部联合国际项目部共同开展《项目管理知识在数据管理工作中的应用》主题系列培训。《项目管理知识在数据管理工作中的应用》包含项目整合管理、项目范围管理、项目进度管理、项目质量管理、项目资源管理、项目沟通管理、项目风险管理、项目相关方管理等八个模块内容,主要参考项目管理知识体系指南(PMBOK指南)的理论知识,并结合数据管理工作内容和项目实践经验进行展开。